- Acide bromoacétique
-
Acide bromoacétique 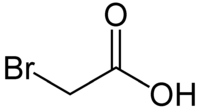
Général Nom IUPAC acide bromoéthanoïque No CAS No EINECS SMILES InChI Apparence cristaux incolores Propriétés chimiques Formule brute C2H3BrO2 [Isomères] Masse molaire[1] 138,948 ± 0,003 g·mol-1
C 17,29 %, H 2,18 %, Br 57,51 %, O 23,03 %,pKa 2,69 Propriétés physiques T° fusion 50 °C[2] T° ébullition 208 °C[2] Solubilité 93,8 g·l-1 (eau, 25 °C)[2] Masse volumique 1,93 g·cm-3 (20 °C)[2] Point d’éclair > 112 °C (coupelle fermée)[2] Pression de vapeur saturante 0,07 mbar (20 °C)[2]0,17 mbar (30 °C)[2]0,95 mbar (50 °C) Propriétés optiques Indice de réfraction 1,4804 (50 °C) Précautions Directive 67/548/EEC 
T
C
NPhrases R : 23/24/25, 35, 43, 50, Phrases S : (1/2), 26, 36/37/39, 45, 61, Transport 80 1938
80 3425 NFPA 704 Écotoxicologie DL50 100 mg·kg-1 (souris, oral)[3]
66 mg·kg-1 (souris, i.p.)[4]LogP 0,41[2] Composés apparentés Autres composés acide chloroacétique Unités du SI & CNTP, sauf indication contraire. L'acide bromoacétique (ou monobromoacétique) est un composé organique dérivé de l'acide acétique (acide éthanoïque), où l'un des atomes d'hydrogène du groupement méthyle a été substitué par un atome de brome. Ses sels sont appelés bromoacétates.
Sommaire
Propriétés
L'acide bromoacétique se présente sous la forme de cristaux incolores ayant une odeur âcre, qui fondent vers 50 °C et se dissolvent facilement dans l'eau, l'éthanol, l'éther diéthylique et dans d'autres solvants organiques. Sa solution aqueuse est fortement acide, beaucoup plus acide que l'acide acétique (pKa de 2,69 contre 4,76 pour ce dernier), car l'anion bromoacétate ainsi formé est stabilisé par l'atome de brome, électronégatif, et qui permet ainsi de mieux délocaliser la charge négative dans la molécule. Il agit d'électrons et distribués (délocalisées) charge négative de l'anion sur la molécule entière.
Synthèse
L'acide bromoacétique peut être synthétisé par bromation de l'acide acétique[5]
Il peut aussi être obtenu par réaction de l'acide chloroacétique avec la bromure de sodium, par réaction de substitution nucléophile :
Utilisations
L'acide bromacétique est un produit de départ pour de nombreuses synthèses, par exemple de pesticides ou de médicaments. Il a été utilisé de façon directe comme conservateur alimentaire, mais cette utilisation est désormais interdite dans la plupart des États.
L'acide bromacétique est un alkylant fort et possède un effet inhibiteur sur les enzymes portant un groupement -SH (thiol), -OH (alcool) ou NH2 sur leur site actif. Il a autrefois été utilisé pour adoucir le vin français[6]. Un scandale éclata dans les années 1980 en RFA quand fut découvert son utilisation comme conservateur de la bière[7]
Les esters volatiles de l'acide bromoacétique sont utilisés comme gaz lacrymogènes ; ils sont irritants pour le système respiratoire et les yeux, et peuvent être nocifs. À des concentrations plus élevées, ils sont corrosifs et peuvent causer des dommages permanents aux yeux.
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Entrée du numéro CAS « 79-08-3 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais) (JavaScript nécessaire)
- United States Environmental Protection Agency, Office of Pesticides and Toxic Substances. Vol. 8EHQ-0391-1149
- Journal of the National Cancer Institute. Vol. 31, Pg. 297, 1963.
- Natelson, S.; Gottfried, S. (1955). "Ethyl Bromoacetate". Org. Synth.; Coll. Vol. 3: 381.
- (de)Universität Regensburg: Essigsäure eine „Allerweltssubstanz“
- (de) Kantonales Amt für Lebensmittelkontrolle St.Gallen
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Bromessigsäure » (voir la liste des auteurs)
Catégories :- Produit chimique toxique
- Produit chimique corrosif
- Produit chimique dangereux pour l'environnement
- Acide carboxylique
- Composé organo-bromé
Wikimedia Foundation. 2010.






