- Thiirane
-
Thiirane 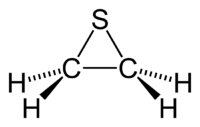
Général Nom IUPAC thiirane Synonymes sulfure d'éthylène
épithioéthaneNo CAS No EINECS No RTECS ChEBI SMILES InChI Apparence liquide habituellement jaune pâle Propriétés chimiques Formule brute C2H4S [Isomères] Masse molaire[3] 60,118 ± 0,007 g·mol-1
C 39,96 %, H 6,71 %, S 53,34 %,Moment dipolaire 2.34 D[1]
1,84 D[2]Propriétés physiques T° ébullition 55,55 °C [4] Masse volumique 1,01 g·cm-3 [5] Thermochimie ΔfH0gaz 82,3 kJ·mol-1 [4] ΔfH0liquide 52 kJ·mol-1 [4] ΔvapH° 30,3 kJ·mol-1 [4] PCI -2 012,6 kJ·mol-1 [4] Propriétés optiques Indice de réfraction  1.495 [5]
1.495 [5]Précautions Directive 67/548/EEC[5] 
T
FPhrases R : 11, 23/25, 41, Phrases S : 16, 36/37/39, 45, Transport[5] - 1992 Écotoxicologie DL50 35,6 mg·kg-1 (souris, oral)
42 mg·kg-1 (rat, i.v.)
90 mg·kg-1 (rat, s.c.)
42 mg·kg-1 (rat, i.p.) [6]CL50 690 ppm (rat, 6h) [6] Unités du SI & CNTP, sauf indication contraire. Le thiirane, ou sulfure d'éthylène, est un composé organique cyclique de formule C2H4S[7]. Il est le plus petit hétérocycle contenant du soufre, il est aussi le composé parent des épisulfures. Comme beaucoup d'organo-sulfurés, ce composé sent très mauvais.
Propriétés physico-chimique
Le thiirane s'additionne sur les amines pour produire des (2-thioéthyl)amines[8] :
- C2H4S + R2NH → R2NCH2CH2SH
Production et synthèse
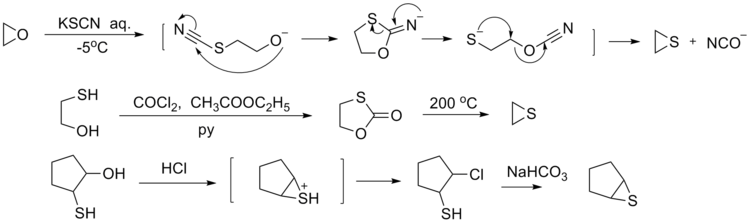
Le thiirane est préparé par réaction entre le carbonate d'éthylène et du thiocyanate de potassium (KSCN)[9]. A cette fin, le KSCN est tout d'abord fondu sous vide pour éliminer toute trace d'eau :
- KSCN + C2H4O2CO → KOCN + C2H4S + CO2
D'autres méthodes de préparation incluent:
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Thiirane » (voir la liste des auteurs)
- (en) Grant N. Merrill, Uri Zoller, Dana R. Reed et Stevens R. Kass, « The Formation and Characterization of Three-Membered Ring Carbanions in the Gas Phase: An Experimental and Theoretical Investigation of the Conjugate Bases of Thiirane, Thiirane S-Oxide, and Thiirane S,S-Dioxide », dans Journal of Organic Chemistry, vol. 64, no 20, 1999, p. 7395-7406 [lien DOI (page consultée le 21 janvier 2010)]
- (en) A.A. Scala, M.G. Caputo et D. Billings, « Structural effects on the rates of the ion molecule reactions of organic heterocycles », dans Journal of Heterocyclic Chemistry, vol. 23, no 4, 2009, p. 1027-1030 [lien DOI (page consultée le 20 janvier 2010)]
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) « Thiirane » sur NIST/WebBook, consulté le 21 janvier 2010
- Sigma-Aldricht Catalogue en ligne
- (en) « Ethylene sulfide » sur ChemIDplus, consulté le 21 janvier 2010
- Warren Chew; David N. Harpp, « Recent aspects of thiirane chemistry », dans Journal of Sulfur Chemistry, vol. 15, no 1, 1993, p. 1–39 [lien DOI]
- R. J. Cremlyn, An Introduction to Organosulfur Chemistry, John Wiley and Sons: Chichester (1996). (ISBN 0-471-95512-4).
- Searles, S.; Lutz, E. F.; Hays, H. R.; Mortensen, H. E., Ethylenesulfide, Organic Syntheses, 1973, Collective Volume 5, page 562.
Catégories :- Produit chimique toxique
- Produit chimique facilement inflammable
- Épisulfure
Wikimedia Foundation. 2010.