- Acide chloraurique
-
Acide chloraurique 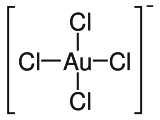
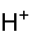
Structure de l'acide chlorauriqueGénéral Nom IUPAC acide tétrachloraurique Synonymes acide aurique
chlorhydrate du trichlorure d'orNo CAS No EINECS PubChem SMILES InChI Apparence cristal hygroscopique en forme d'aiguilles, jaune citron Propriétés chimiques Formule brute HAuCl4 Masse molaire[1] 339,787 ± 0,008 g·mol-1
H 0,3 %, Au 57,97 %, Cl 41,74 %,pKa acide fort Propriétés physiques T° fusion 30 °C (trihydrate) [2] T° ébullition 200 °C (décomposition)[2] Solubilité 150 g·l-1 (eau, 20 °C, trihydrate)[2] Masse volumique 3,9 g·cm-3 (trihydrate, 20 °C)[2] T° d'auto-inflammation non-combustible Précautions Directive 67/548/EEC[2] 
CPhrases R : 34, 43, Phrases S : 26, 36/37/39, 45, Transport[2] 88 3260 SGH[3] 
DangerUnités du SI & CNTP, sauf indication contraire. L'acide chloraurique ou acide tétrachloraurique est un composé inorganique de formule HAuCl4, et est donc principalement constitué d'or et de chlore. Il est avant tout utilisé comme précurseur de l'or.
Sommaire
Production et synthèse
La préparation la plus simple de l'acide chloraurique est la dissolution de l'or dans l'eau régale (mélange d'acide chlorhydrique et d'acide nitrique, une des rares solutions à pouvoir dissoudre l'or).
Un autre méthode consiste à faire réagir le chlorure d'or(III) avec l'acide chlorhydrique :
Propriétés physico-chimiques
L'acide chloraurique cristallise en longues aiguilles jaune citron, qui se dissolvent facilement dans l'eau ou l'éthanol[4] Dans l'eau, l'acide chloraurique, qui perd son proton, a une géométrie de type carré plan (AX4E2). Il est un précurseur d'autres complexes aurifères.
Utilisation
L'acide chloraurique est utilisé comme électrolyte dans le procédé Wohlwill de raffinage de l'or.
Comme le sel le plus commun de l'or, le chlorure d'or(III), il a de nombreuses applications de niche et est largement étudié dans la recherche. Il est par exemple, assez rarement, utilisé pour déposer des particules d'or sous la peau dans l'art corporel. Il est aussi utilisé en photographie comme bain de virage, pour donner une teinte dorée à la photo.
L'or colloïdal et les nanoparticules d'or sont produites en général dans une solution (« méthodes chimiques liquides ») par réduction de l'acide chloraurique par le sulfure de sodium, bien que des méthodes alternatives existent, comme la réaction de Norrish.
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Entrée du numéro CAS « 16903-35-8 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 30/09/09 (JavaScript nécessaire)
- SIGMA-ALDRICH
- (de) Goldverbindungen. In: Roempp Chemie Lexikon, Thieme Verlag, 2008, online
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Tetrachloridogoldsäure » (voir la liste des auteurs)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Chloroauric acid » (voir la liste des auteurs)
Catégories :- Composé de l'or
- Produit chimique corrosif
- Acide
Wikimedia Foundation. 2010.


