- Acide nitrochlorhydrique
-
Eau régale
 Eau régale utilisée pour le nettoyage de tubes RMN
Eau régale utilisée pour le nettoyage de tubes RMN
L’eau régale (latin, aqua regia, eau royale) est un mélange d’acide chlorhydrique et d’acide nitrique concentrés (3 volumes d’acide chlorhydrique pour 1 d’acide nitrique) capable de dissoudre certains métaux nobles tels le platine, l'or ou le tantale insolubles dans ces acides seuls ou, tout autre acide simple concentré. C'est pourquoi cette solution est aussi connue sous le nom « d'eau royale ».
Sommaire
Applications
L'eau régale est avant tout utilisée dans la production d'acide chloraurique, l'électrolyte utilisé dans le procédé Wohlwill. Ce procédé est utilisé pour le raffinage d'or de très grande pureté (99,999%).
L'eau régale est aussi utilisée comme agent de gravure et pour certaines analyses chimiques. Elle est aussi utilisée dans certains laboratoires pour nettoyer la verrerie des composés organiques et des particules de métal. Cette méthode est d'ailleurs préférée pour le nettoyage des tubes RMN à la méthode « traditionnelle » du bain dans l'acide chromique, cette dernière pouvant laisser des traces de chrome pouvant perturber le spectre de l'analyse suivante[1]. De plus les bains d'acides chromiques sont dangereux du fait de la haute toxicité du chrome et des risques d'explosion. Cependant l'eau régales est elle même très corrosive, et a été à l'origine de nombreuses explosions dues à de mauvais manipulations[2].
Fonctionnement
Chaque constituant de l'eau régale joue un rôle dans la dissolution de l'or.
L'acide nitrique est un puissant oxydant, mais pas assez pour permettre l'oxydation de quantité significative d'or :
Au(s) + 3NO3-(aq) + 6H+(aq) ⇔ Au3+(aq) + 3NO2(aq) + 3H2O(l)
Cette réaction est en effet un équilibre, qui n'est pas déplacé dans le sens de la formation de l'ion aurifère.
L'acide chlorhydrique fournit des ions chlorures ((Cl-)) qui permettent le déplacement de l'équilibre par la formation des anions chloraurates (AuCl4-) :
Au3+(aq) + 4Cl-(aq) ⇔ AuCl4 (aq)-
la réaction d'oxydation est donc :
Au(s) + 3NO3-(aq) + 6H+(aq) + 4Cl-(aq) ⇔ AuCl4 (aq)- + 3NO2(aq) + 3H2O(l)
La réaction avec le platine est un peu plus complexe, mais similaire. La réaction initiale produit un mélange d'acide chloroplateux (H2PtCl4) et de chlorure nitrosoplatinique ((NO)2PtCl4). Le chlorure nitrosoplatinique est un solide qui peut être redissout par lavage à l'acide chlorhydrique concentré.
- Pt (s) + 2 HNO3 (aq) + 4 HCl (aq)
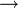 (NO)2PtCl4 (s) + 3 H2O (l) + 1/2 O2 (g)
(NO)2PtCl4 (s) + 3 H2O (l) + 1/2 O2 (g)
- (NO)2PtCl4 (s) + 2 HCl (aq)
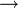 H2PtCl4 (aq) + NOCl (g)
H2PtCl4 (aq) + NOCl (g)
Décomposition
L'eau régale n'est pas très stable, elle se décompose rapidement par formation de chlorure de nitrosyle et de chlore :
HNO3 (aq) + 3 HCl (aq)
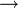 NOCl (g) + Cl2 (g) + 2 H2O (l)
NOCl (g) + Cl2 (g) + 2 H2O (l)Le chlorure de nitrosyle se décompose par la suite :
2 NOCl (g)
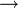 2 NO (g) + Cl2 (g)
2 NO (g) + Cl2 (g)Les produits de ces réactions n'ont pas le pouvoir oxydant de l'acide nitrique, et donc avec le temps l'eau régale perd ses propriétés. Elle doit donc être préparée juste avant utilisation.
Histoire
 Jabir ibn Hayyan, manuscrit du XVe siècle
Jabir ibn Hayyan, manuscrit du XVe siècle
L'eau régale fut découverte au IXe siècle par l'alchimiste arabo-yéménite Jabir ibn Hayyan qui découvrit aussi l'acide chlorhydrique. Le mélange fut nommé « eau régale » (eau royale) par les alchimistes car il pouvait dissoudre les métaux nobles comme l'or.
Anecdote historique
Pendant la Seconde Guerre mondiale, au moment de la conquête du Danemark par le troisième Reich, George de Hevesy (chimiste hongrois) voulut éviter le vol par les Nazis du prix Nobel en or de Max von Laue et James Franck. Il réalisa la dissolution des deux médailles et la solution résultante fut gardée dans un laboratoire à l’institut Niels Bohr. George de Hevesy récupéra la solution après la guerre. La précipitation d'un sel d’or fut provoquée et la société Nobel refondit la distinction à partir de l’or du premier prix.
Notes et références
- ↑ Hoffman, R., How to make an NMR sample, Hebrew University, 10 Mar 2005. Accessed 31 Oct 2006.
- ↑ (en) American Industrial Hygiene Association, Laboratory Incidents: Explosions, 8 Dec 2004. Accédé le 31 octobre 2006.
- Portail de la chimie
Catégorie : Acide - Pt (s) + 2 HNO3 (aq) + 4 HCl (aq)
Wikimedia Foundation. 2010.
