- Dioxyde de plutonium
-
Dioxyde de plutonium 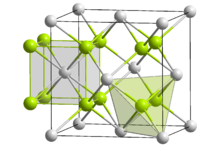
__ Pu4+ __ O2−
Structure du dioxyde de plutoniumGénéral Nom IUPAC Dioxyde de plutonium Synonymes Oxyde de plutonium(IV) No CAS No EINECS Apparence Solide jaune à vert olive Propriétés chimiques Formule brute PuO2 Masse molaire[1] 276 g·mol-1
O 11,59 %, Pu 88,43 %,Propriétés physiques T° fusion 2 400 °C T° ébullition 2 800 °C Solubilité insoluble Masse volumique 11 500 kg·m-3 Cristallographie Système cristallin Fm3m Classe cristalline ou groupe d’espace Cubique Structure type fluorite (CaF2)[2] Paramètres de maille 540 pm Précautions 
Composé radioactifUnités du SI & CNTP, sauf indication contraire. Le dioxyde de plutonium est un composé chimique de formule PuO2. C'est une céramique réfractaire de couleur jaune à vert olive selon la taille de ses grains, sa température et son mode de fabrication[3]. Il s'agit du principal composé du plutonium du point de vue des applications de ce métal.
Sommaire
Structure
Le dioxyde de plutonium a la même structure cristalline que la fluorine CaF2, qui est également celle du dioxyde d'uranium et du dioxyde de neptunium : les cations Pu4+ occupent les nœuds d'un réseau cubique face centrée tandis que les anions O2- occupent les sites tétraédriques[4]. Le PuO2 se prête bien aux applications nucléaires en raison des lacunes dans les sites octaédriques, qui offrent de la place pour les produits de fission sans briser la structure cristalline du matériau.
Fabrication
Le plutonium métallique s'oxyde spontanément en dioxyde de plutonium PuO2 lorsqu'il est exposé à l'oxygène. Industriellement, il est produit par calcination à 300 °C de l'oxalate de plutonium Pu(C2O4)2.6H2O issu du traitement du combustible nucléaire usé.
Applications
Le dioxyde de plutonium entre dans la composition du combustible MOX utilisé par certains réacteurs nucléaires. Le dioxyde de plutonium 238 est utilisé comme source d'énergie pour les sondes spatiales dans leur générateur thermoélectrique à radioisotope, comme c'est le cas de la sonde New Horizons destinée à atteindre le système de (134340) Pluton en été 2015. L'isotope 238Pu se désintègre en effet essentiellement en émettant des particules α dont il est possible de convertir efficacement l'énergie cinétique en énergie thermique : la puissance spécifique du plutonium 238 pur est d'environ 567 W/kg, soit environ 390 W/kg sous forme de dioxyde de plutonium PuO2 — l'isotope 238Pu n'est jamais pur, il est généralement concentré entre 75 à 80 %, avec souvent entre 15 et 20 % de 239Pu et divers autres actinides.
Cette technologie présente de très nombreux avantages du point de vue de l'exploration spatiale, mais suscite toujours la méfiance du public quant aux risques de contamination radioactive en cas d'accident lors du lancement ou en cas de chute de l'engin dans l'atmosphère terrestre — dans la mesure par exemple où New Horizons a dû repasser très près de la Terre pour bénéficier de son assistance gravitationnelle par effet de fronde avant de mettre le cap vers Jupiter.
Sécurité
Comme tous les composés du plutonium, le dioxyde de plutonium est tracé dans le cadre du traité sur la non-prolifération des armes nucléaires. Le PuO2 est chaud au toucher en raison de son intense radioactivité α, comme le sont d'ailleurs tous les autres composés du plutonium. Ce dernier n'est pas seulement radiotoxique, mais également toxique d'un point de vue chimique, particulièrement par inhalation[5].
Références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) Bodie E. Douglas, Shih-Ming Ho, Structure and Chemistry of Crystalline Solids, Pittsburgh, PA, USA, Springer Science + Business Media, Inc., 2006, 346 p. (ISBN 0-387-26147-8)
- Los Alamos National Laboratory: Nitric acid processing.
- Norman N. Greenwood, A. Earnshaw, (1984) Chemistry of the Elements, Oxford: Pergamon, p. 1471, ISBN 0-08-022057-6
- Toxicological Profile For Plutonium, U.S. Department of Health and Human Services, 2007-09-27. Consulté le 2009-04-23
Voir aussi
Articles connexes
- Agence internationale de l'énergie atomique
- Traité sur la non-prolifération des armes nucléaires
- Dihydrure de plutonium
Liens externes
Catégories :- Composé du plutonium
- Oxyde
- Matériau nucléaire
Wikimedia Foundation. 2010.

