- ZnCl2
-
Chlorure de zinc
 Pour les articles homonymes, voir Zinc (homonymie).
Pour les articles homonymes, voir Zinc (homonymie).Chlorure de zinc 
Général Nom IUPAC Chlorure de zinc No CAS No EINECS SMILES InChI Apparence solide de forme variable, hygroscopique et blanc[1] Propriétés chimiques Formule brute ZnCl2 Masse molaire 136,29 g∙mol-1
Cl 52,03 %, Zn 47,98 %,Propriétés physiques T° fusion 290 °C[1] T° ébullition 732 °C[1] Solubilité dans l'eau à 25 °C : très bonne (432 g/100 ml)[1],
100/100 ml eau (12,5 °C,eau)Masse volumique 2.9 g/cm³[1] Précautions Directive 67/548/EEC 
C
NPhrases R : 22, 34, 50/53, Phrases S : (1/2), 26, 36/37/39, 45, 60, 61, Transport - 2331 SIMDUT[2] 
SGH[3] 

DangerUnités du SI & CNTP, sauf indication contraire. Le chlorure de zinc est un sel de zinc de formule chimique ZnCl2. C'est un solide blanc ou incolore, extrêmement hygroscopique.
Quatre structures cristallines différentes ont été observées, mais seul la forme δ (hexagonal compact) peut se former lorsque le composé est pur et anhydre. S'il subit une trempe rapide, ZnCl2 peut être obtenu sous forme vitreuse.
Les solutions aqueuses concentrées de chlorure de zinc ont la propriété de dissoudre l'amidon, la soie et la cellulose. Elles ne peuvent donc pas être filtrées à travers du papier de filtration standard.
Le chlorure de zinc a de nombreuses applications dans l'industrie textile, la métallurgie et la synthèse chimique.
Sommaire
Propriétés chimiques
Le chlorure de zinc est un sel ionique, qui possède tout de même un caractère covalent qui est mis en évidence par sa température de fusion relativement basse (275 °C) et sa solubilité élevée dans des solvants comme l'éther. Il se comporte comme un acide de Lewis) modéré, et les solutions de chlorure de zinc ont un pH voisin de 4. Lorsqu'il est chauffé sous une forme hydratée, il s'hydrolyse pour former de l'oxychlorure de zinc.
En solution aqueuse, le chlorure de zinc est une source d'ions Zn2+ utile pour la préparation d'autres sels de zinc comme par exemple le carbonate de zinc :
ZnCl2(aq) + Na2CO3(aq) → ZnCO3(s) + 2 NaCl(aq)
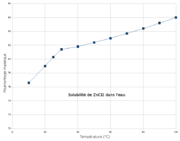 Solubilité dans l'eau
Solubilité dans l'eau
Préparation et purification
Le chlorure de zinc anhydre est obtenu à partir de zinc métal et de chlorure d'hydrogène :
Zn + 2 HCl(g) → ZnCl2(s) + H2(g)
Les formes hydratées et le sel en solution aqueuse peuvent être préparés directement en utilisant une réaction acido-basique, par exemple à partir du minerai de sulfure de zinc :
ZnS(s) + 2 HCl(aq) → ZnCl2(aq) + H2S(l)
Le chlorure de zinc commercial contient généralement de l'[eau]) et de l'oxychlorure de zinc produit par hydrolyse. Ces produits peuvent être purifiés comme suit : 100 g de ZnCl2 commercial sont chauffé à reflux dans 800 ml de dioxane anhydre en présence de poussière de zinc métallique. Le mélange est filtré à chaud (pour retirer le zinc), puis refroidi pour former un précipité blanc de chlorure de zinc pur. Les échantillons anhydres peuvent être purifiés par sublimation sous un flux de chlorure d'hydrogène, suivi par un chauffage à 400 °C sous un flux d'azote sec.
Applications
Le chlorure de zinc est notamment utilisé pour le soudage, du fait de sa capacité de dissoudre les oxydes métalliques lors qu'il est à l'état fondu. Cette propriété permet également de l'utiliser dans les ciments à base d'oxyde de magnésium pour les prothèses dentaires. ZnCl2 est utilisé également comme agent d'ignifugation et comme réactif d'attaque de métaux.
Le chlorure de zinc est également utilisé dans la galvanisation, ainsi que dans le production de batteries.
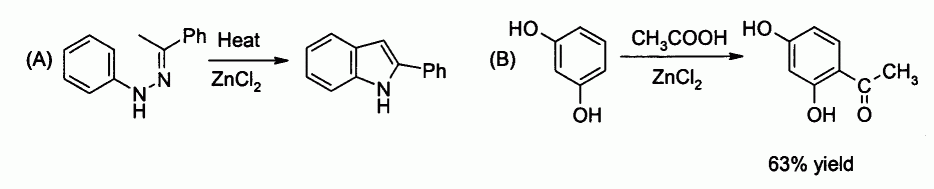
En laboratoire, le chlorure de zinc est utilisé en tant qu'acide de Lewis modéré. Il peut jouer le rôle de catalyseur pour la synthèse de Fisher de l'indole (A) ou pour l'acylation de Friedel-Crafts mettant en jeu un composé aromatique (B) :
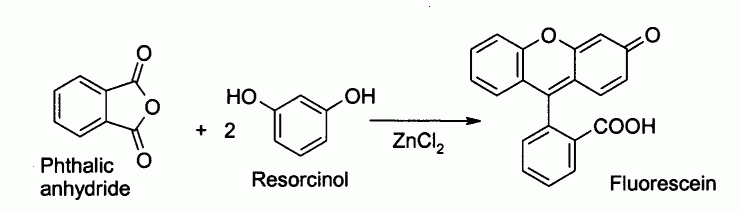
Il est notamment utilisé pour la préparation de fluorescéine par acylation de Friedel-Crafts à partir d'anhydride phtalique et de résorcinol :
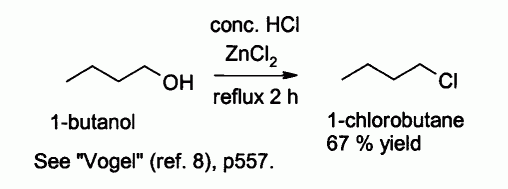
L'acide chlorhydrique seul réagit mal avec les alcools primaires et les alcools secondaires, mais un mélange d'acide chlorhydrique et de chlorure de zinc (mélange connu sous le nom de "réactif de Lucas"), permet la préparation de chlorures d'alkyles. Le mécanisme de cette réaction est probablement de type SN2 avec les alcools primaires et de type SN1 avec les alcools secondaires.
Le chlorure de zinc est capable d'activer des halogénures de benzyle ou d'allyle ce qui permet des réactions de substitution par des nucléophiles faibles comme les alcènes :
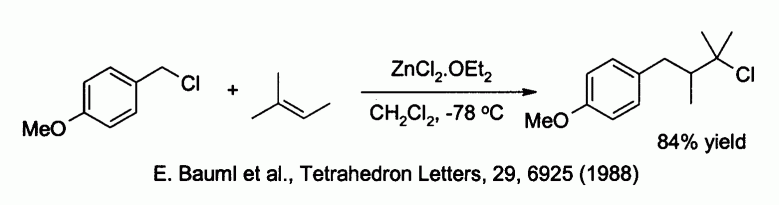
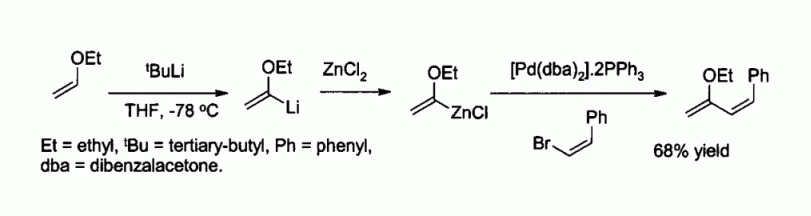
Le chlorure de zinc est également un réactif utilisé pour la synthèse de nombreux réactifs de type organozincites, comme par exemple ceux utilisés pour le couplage de Negishi avec des halogénures d'aryle ou de vinyle. L'organozincite est alors généralement préparé par échange métallique avec un organolithié ou un réactif de Grignard, comme par exemple dans :
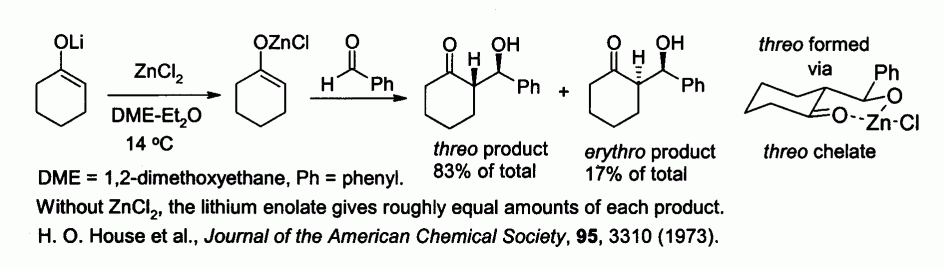
Les énolates de zinc, préparés à partir d'énolates de métaux alcalins et de chlorure de zinc, permettent de contrôler la stéréochimie lors de réactions de condensation d'aldols, du fait de la chélation du zinc. Dans l'exemple ci-dessous, le produit thréo est favorisé par rapport au produit érythro (facteur 5/1) lorsque est utilisé du chlorure de zinc :
Sécurité
Le chlorure de zinc est corrosif et irritant, et doit être manipulé avec précautions. Il est conseillé de porter des lunettes de sécurité et des gants.
- R: 34 (Provoque des brûlures)
- R: 50 (Très toxique pour les organismes aquatiques)
- R: 53 (Peut entraîner des effets néfastes à long terme pour l'environnement aquatique)
- S: 7 (Conserver le récipient bien fermé)
- S: 8 (Conserver le récipient à l'abri de l'humidité)
- S: 28 (Après contact avec la peau, se laver immédiatement et abondamment avec... (précisé par le fabricant))
- S: 45 En cas d'accident ou de malaise, consulter immédiatement un médecin (si possible lui montrer l'étiquette)
- S: 60 (Eliminer le produit et son récipient comme un déchet dangereux)
- S: 61 (Eviter le rejet dans l'environnement. Consulter les instructions spéciales/la fiche de données de sécurité)
Références
- N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997.
- Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- The Merck Index, 7th edition, Merck & Co, Rahway, New Jersey, USA, 1960.
- D. Nicholls, Complexes and First-Row Transition Elements, Macmillan Press, London, 1973.
- A. F. Wells, 'Structural Inorganic Chemistry, 5th ed., Oxford University Press, Oxford, UK, 1984.
- J. March, Advanced Organic Chemistry, 4th ed., p. 723, Wiley, New York, 1992.
- G. J. McGarvey, in Handbook of Reagents for Organic Synthesis, Volume 1: Reagents, Auxiliaries and Catalysts for C-C Bond Formation, (R. M. Coates, S. E. Denmark, eds.), pp. 220-3, Wiley, New York, 1999.
- B. S. Furnell et al., Vogel's Textbook of Practical Organic Chemistry, 5th edition, Longman/Wiley, New York, 1989.
- R. L. Shriner, W. C. Ashley, E. Welch, in Organic Syntheses Collective Volume 3, p 725, Wiley, New York, 1955.
- (a) S. R. Cooper, in Organic Syntheses Collective Volume 3, p 761, Wiley, New York, 1955. (b) S. Y. Dike, J. R. Merchant, N. Y. Sapre, Tetrahedron, 47, 4775 (1991).
- E. Bauml, K. Tschemschlok, R. Pock, H. Mayr, Tetrahedron Letters, 29, 6925 (1988).
- S. Kim, Y. J. Kim, K. H. Ahn, Tetrahedron Letters, 24, 3369 (1983).
- H. O. House, D. S. Crumrine, A. Y. Teranishi, H. D. Olmstead, Journal of the American Chemical Society, 95, 3310 (1973).
- ↑ a , b , c , d et e DICHLORURE DE ZINC, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Chlorure de zinc » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Portail de la chimie
Catégories : Composé du zinc | Produit chimique corrosif | Produit chimique dangereux pour l'environnement | Chlorure
Wikimedia Foundation. 2010.
