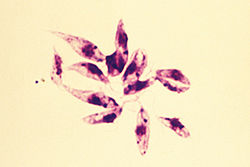
- B55
-
Leishmaniose
Leishmaniose CIM-10 : B55 Les leishmanioses sont des affections cutanées ou viscérales dues à des protozoaires flagellés appartenant au genre Leishmania de la famille des Trypanosomidae et transmises par la piqûre de certaines espèces de phlébotomes, comprenant les mouches du genre Lutzomyia dans le Nouveau monde et Phlebotomus dans l’Ancien monde.
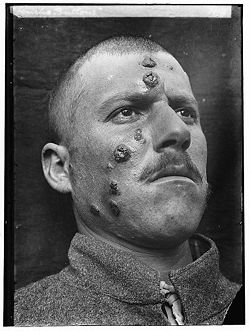 Forme cutanée de leishmaniose, dite « de Jéricho » en raison de sa fréquence dans la région de Jéricho
Forme cutanée de leishmaniose, dite « de Jéricho » en raison de sa fréquence dans la région de Jéricho
Sommaire
Historique
La maladie, également autrefois nommée bouton d'Orient, Clou de Biskra, Bouton d'Alep, kala azar, fièvre noire, fièvre à phlébotome, fièvre Dum-Dum ou espundia n'a été complètement médicalement décrite qu'en 1901 par l’anatomopathologiste écossais William Boog Leishman, mais la transmission de la leishmaniose par certains de ses vecteurs (moucherons en l'occurrence) avait déjà été étudiée dès 1786 par l’italien Scopoli, sans qu'il n'ait toutefois compris le rôle des phlébotomes[1]. Il faudra pour cela attendre les expériences des frères Sergent (de 1901 à 1904). La transmission de Leishmania infantum chez le chien ou l’Homme n'a été établie qu'en 1926 par Parrot et Donatien.
Parasite
La plupart des formes de la maladie sont transmissibles seulement aux animaux , mais certaines peuvent être transmises aux humains (zoonose). L'infection humaine est provoquée par environ 21 des 30 espèces qui infectent les mammifères. Parmi celles-ci on regroupe le complexe de L. donovani avec trois espèces (L. donovani, L. infantum et L. chagasi) ; le complexe de L. mexicana avec 3 espèces principales (L. mexicana, L. amazonensis et L. venezuelensis) ; L. Tropica ; L. major ; L. aethiopica ; et le sous-genre Viannia avec quatre espèces principales (L. (V.) braziliensis, L. (V.) guyanensis, L. (V.) panamensis, L. (V.) peruviana. Les différentes espèces sont morphologiquement impossibles à distinguer, mais elles peuvent être différenciées par analyse des isoenzymes, analyse des séquences ADN, ou anticorps monoclonaux.
La leishmaniose viscérale est une forme sévère dans laquelle les parasites ont migré dans les organes vitaux.
Répartition géographique et épidémiologie
La leishmaniose peut être contractée dans de nombreux pays tropicaux et subtropicaux, et on la retrouve dans des régions relevant de 88 pays environ. Approximativement 350 millions de personnes vivent dans les zones d’endémie. Les conditions climatiques compatibles avec le développement de la leishmaniose sont très larges, allant des forêts tropicales d’Amérique centrale et d’Amérique du Sud aux déserts d’Asie occidentale. Plus de 90 pour cent des cas mondiaux de leishmaniose viscérale se rencontrent en Inde, au Bangladesh, au Népal, au Soudan et au Brésil.
La leishmaniose est également retrouvée au Mexique, en Amérique Centrale, et en Amérique du Sud, du nord de l'Argentine au sud du Texas (sauf en Uruguay ou au Chili), l'Europe méridionale (la leishmaniose n'est pas répandue chez les voyageurs à destination de l’Europe méridionale), l'Asie (sauf le Sud-est asiatique), le Moyen-Orient, et l'Afrique (particulièrement l’Afrique du Nord et de l’Est, avec quelques cas ailleurs). La maladie n'existe pas en Australie ou en Océanie.
La leishmaniose est présente en Irak et a été contractée par un certain nombre de soldats des troupes impliquées dans l’invasion de ce pays en 2003 et dans son occupation. Les soldats ont surnommé la maladie le furoncle de Bagdad . On a rapporté à l’Agence France-Presse que plus de 650 soldats des États-Unis auraient contracté la maladie entre le début de l'invasion en mars 2003 et fin 2004 [2],[3].
En 2004, on a calculé qu'environ 3400 hommes de troupe de l'armée colombienne, opérant dans la jungle du sud du pays (en particulier autour des départements de Meta et de Guaviare), ont été atteints par la leishmaniose. Apparemment, une des raisons qui a contribué à cette épidémie était le fait que plusieurs des soldats atteints n'avaient pas utilisé le produit répulsif, mis à leur disposition en raison d’une odeur prétendument désagréable. On estime que près de 13 000 cas de la maladie ont été enregistrés dans l’ensemble de la Colombie tout au long de l’année 2004, et environ 360 nouveaux cas parmi des soldats avaient été recensés en février 2005 [4],[5],[6].
En septembre 2005 la maladie a été contracté par au moins quatre marines hollandais qui ont stationné à Mazari Sharif, en Afghanistan et ont été rapatriés pour traitement.
Cycle parasitaire
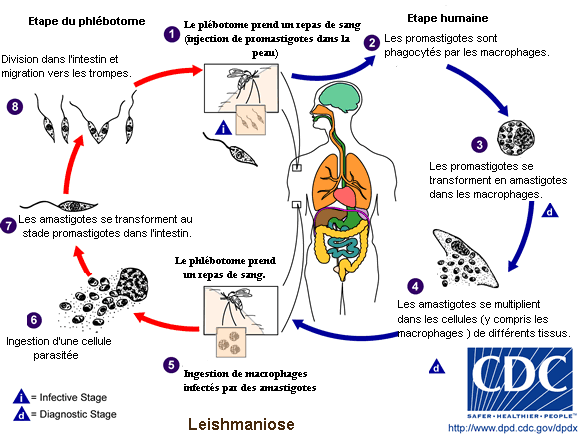
Cycle parasitaire des Leishmanioses. Cliquer sur l’image pour agrandir
La leishmaniose est transmise par la piqûre des phlébotomes femelles. Les phlébotomes injectent la larve au stade infectieux, de promastigotes métacycliques, pendant le repas de sang (1). Les promastigotes métacycliques qui atteignent la plaie de piqûre sont phagocytées par les macrophages (2) et se transforment en amastigotes (3). Les amastigotes se multiplient dans les cellules infectées et atteignent différents tissus, suivant (du moins en partie) l’espèce de Leishmania qui est impliquée (4). Ces spécificités d’atteinte tissulaires différentes sont la cause des manifestations cliniques qui différent dans les diverses formes de leishmaniose. Les phlébotomes s’infectent pendant les repas de sang sur un hôte infecté quand ils ingèrent des macrophages porteurs d’ amastigotes (5.6). Dans l’intestin du phlébotome, les parasites se différencient en promastigotes (7), qui se multiplient et se différencient en promastigotes metacycliques et migrent dans la trompe du phlébotome (8).
Cycle évolutif: http://leish.ifrance.com/Utilitaires/Cycle.swf
Signes cliniques
Les symptômes de la leishmaniose sont des plaies cutanées qui apparaissent des semaines ou des mois après que la personne infectée a été piquée par le phlébotome. Parmi les autres conséquences, qui peuvent devenir manifestes n'importe quand à partir de quelques mois jusqu’à plusieurs années après infection, on compte la fièvre, l’atteinte de la rate et du foie, et l’anémie. Sur le plan médical, la leishmaniose est l'une des causes connue de splénomégalie (augmentation de volume de la rate), qui peut devenir plus grosse même que le foie. Il y a quatre formes principales de leishmaniose :
- La leishmaniose viscérale – la forme la plus grave et potentiellement mortelle en l’absence de traitement.
- La leishmaniose cutanée – la forme la plus répandue qui provoque de nombreuses plaies sur le corps, qui guérissent en quelques mois laissant les cicatrices particulièrement inesthétiques.
- La leishmaniose cutanée diffuse – cette forme produit des lésions cutanées étendues qui ressemblent à celles de la lèpre et sont particulièrement difficiles à traiter.
- La leishmaniose cutanéo-muqueuse – débute avec des ulcérations cutanées qui s’étendent et endommagent certains tissus (en particulier le nez et la bouche).
Leishmanioses viscérales
Article détaillé : Leishmaniose viscérale.Dues à deux sous-espèces de Leishmania donovani : L. d. infantum et L. d. donovani, elles sont décrites sous le nom de kala-azar.
L'incidence mondiale est de l'ordre de 500 000 nouveaux cas annuels. Elles sont plus fréquentes dans les pays du pourtour méditerranéen, au Brésil, au Soudan et dans la péninsule indienne.
Les réservoirs de L. infantum sont le chien, le renard et des autres membres de la famille des canidae; l'homme est le réservoir unique de L. d. donovani. La transmission est essentiellement effectuée par la piqûre de phlébotomes infectés.
Le tableau clinique caractéristique de la maladie est celui d'une splénomégalie majeure anémiante avec teint cireux et fièvre, qui se constitue en quelques mois d'évolution.
Le diagnostic de certitude est affirmé par l'identification du parasite dans les tissus. Plusieurs méthodes sérologiques sont disponibles avec une bonne fiabilité[7].
Leishmanioses cutanées
Article détaillé : Leishmaniose cutanée.Dans l'ancien monde, elles sont dues à Leishmania major, L. tropica ou L. aethiopica. Elles portent des noms divers selon les régions :
- Bouton d'Orient ou Clou de Biskra sur le pourtour méditerranéen
- Bouton d'Alep au Proche-Orient
Dans le nouveau monde, elles sont dues à Leishmania mexicana, L. panamensis, L. amazonensis, L. peruviana, L. braziliensis ou L. guyanensis.
- uta au Pérou
- espundia au Brésil (réservoir : paresseux)
- pian-bois (zones forestières humides de l'Amérique du Sud)
Elles sont toutes transmises par la piqûre de phlébotomes infectés, et les réservoirs sont divers et pas toujours bien connus: certaines espèces de rongeurs, chiens, etc.
Le bouton d'Orient est une lésion d'inoculation du parasite par le phlébotome vecteur (Afrique du nord, Asie mineure, Amérique du Sud). Après 2 semaines d'incubation, apparait une papule prurigineuse qui s'ulcère puis prend l'aspect d'une furonculose localisée. Cette lésion est indolore et siège sur les parties découvertes du corps (le front par exemple). Le parasite est retrouvé dans le fond des ulcérations, il doit faire l'objet d'une recherche au microscope. Le traitement est local, il consiste en l'injection d'antimoniate de méglumine (en France : Glucantime®) tout autour de la lésion. Ces injections sont parfois renouvelées une deuxième fois si la lésion est profonde. Elles n'empêchent cependant pas la constitution, plusieurs semaines, mois ou années après, d'une leishmaniose viscérale.
Traitement
Il existe deux molécules couramment utilisées contenant de l’antimoine, l’antimoniate de meglumine (® Glucantim ) et le stibogluconate de sodium (® Pentostam ). On n’a pas complètement élucidé le mécanisme d’action de ces produits contre le parasite ; elles peuvent perturber son mécanisme de production d’énergie ou le métabolisme de la trypanothione. Malheureusement, dans beaucoup de régions du monde, le parasite est devenu résistant à l'antimoine et pour la leishmaniose viscérale ou cutanéo-muqueuse [8] l'amphotericine (® Ambisome ) est maintenant le traitement de choix. L'échec de l'Ambisome® pour traiter la leishmaniose viscérale (Leishmania donovani) a été rapporté au Soudan [9]. Mais cet échec peut être attribué à des facteurs dépendants de l’hôte, telles la co-infection avec le VIH ou la tuberculose davantage que par la résistance du parasite.
La Miltefosine (Impavido®), est un nouveau médicament pour traiter la leishmaniose viscérale et cutanée. Le taux de bons résultats pour la miltefosine dans la phase III des essais cliniques est de 95% ; Des études en Éthiopie montrent qu’il est également efficace en Afrique. Chez les malades immunodéprimés atteints du VIH et qui sont co-infectées par la leishmaniose, il a été prouvé que même dans les formes résistantes 2/3 des patients réagissent à ce nouveau traitement. Des essais cliniques en Colombie ont montré un taux d’efficacité élevé pour la leishmaniose cutanée. Dans les formes cutanéo-muqueuses provoquées par L. brasiliensis ce traitement s’est montré plus efficace que d'autres molécules. La Miltefosine a reçu l'autorisation de mise sur le marché des autorités indiennes en 2002 et allemandes en 2004. En 2005 il a reçu la première autorisation pour la leishmaniose cutanée en Colombie. La Miltefosine est actuellement évaluée également pour le traitement de la leishmaniose cutanéo-muqueuse provoquée par le L. braziliensis en Colombie [8] et les résultats préliminaires sont très prometteurs. Il est maintenant autorisé dans de nombreux pays et c’est la première percée thérapeutique pour un traitement administré par voie orale pour la leishmaniose viscérale et cutanée [10](More, et al, 2003).
En octobre 2006 il a reçu le statut médicament orphelin de la Food and drug administration des USA. La molécule est généralement mieux tolérée que d'autres médicaments. Les effets secondaires principaux sont des troubles de gastro-intetinaux dans les 1 à 2 premiers jours du traitement ce qui n'affecte pas son efficacité. Puisqu'il est disponible pour un traitement par voie orale, il évite les dépenses et les inconvénients de l'hospitalisation, ce qui fait de lui une alternative intéressante.
L'institut pour la santé mondiale a développé la paromomycine, dont les résultats ont conduit à son inscription comme médicament orphelin.
L'initiative des médicaments pour les maladies négligées facilite également activement la recherche pour de nouvelles thérapeutiques. La leishmaniose résistante aux médicaments peut répondre favorablement à l'immunothérapie (inoculation d’antigènes du parasite associés à un adjuvant) qui vise à stimuler le propre système immunitaire du malade pour éliminer le parasite [11].
Plusieurs vaccins potentiels sont développés, à la demande de l'organisation mondiale de la santé, mais aucun n'est encore disponible en date de 2006. L'équipe du laboratoire de chimie organique à l'institut fédéral de technologie suisse (ETH) à Zurich essaye de concevoir un vaccin à base d'hydrates de carbone. [5]. Le génome du parasite Leishmania major a été séquencé [12] ce qui rend probablement possible l'identification des protéines qui sont utilisées par l’agent pathogène mais pas par les humains ; ces protéines sont les cibles potentielles pour des traitements médicamenteux.
Voir aussi
Articles connexes
- leishmanioses viscérales (kala azar)
Liens externes
- Les leishmanioses
- Vidéo sur Canal IRD de l'Institut de Recherche pour le Développement : Mise au point d’un vaccin canin contre la leishmaniose viscérale
- Zoonoses-Leishmaniose sur le site du ministère français de la santé
Bibliographie
- Lindgren E., Naucke T. (2006). Leishmaniasis: influences of climate and climate change, epidemiology, ecology and adaptation measures. In : Menne B., Ebi K. Climate change and adaptation strategies for human health, Springer, Darmstadt, p. 131-156.
Notes et références
- ↑ Thèse en ligne de l'Université de Toulouse portant notamment sur les puces et tiques comme vecteurs
- ↑ [1] http://www.veteransforcommonsense.org/index.cfm?page=Article&ID=2377
- ↑ [2] http://www.sptimes.com/2004/06/09/Business/Company_s_mesh_will_h.shtml
- ↑ [3]
- ↑ [4]
- ↑ ::::: [ Documentos / Informes ] - Servicio Jesuita a Refugiados / Venezuela / Acompañar, Servir y Defender :::::
- ↑ (en)A meta-analysis of the diagnostic performance of the direct agglutination test and rK39 dipstick for visceral leishmaniasis, F Chappuis, S Rijal, A Soto, J Menten, M Boelaert, BMJ 2006;333:723
- ↑ a et b Soto J, Toledo JT., « Oral miltefosine to treat new world cutaneous leishmaniasis », dans Lancet Infect Dis, vol. 7, no 1, p. 7
- ↑ Mueller M, Ritmeijer K, Balasegaram M, Koummuki Y, Santana MR, Davidson R., « Unresponsiveness to AmBisome® in some Sudanese patients with kala-azar », dans Trans R Soc Trop Med Hyg, vol. 101, no 1, 2007, p. 19–24 [lien DOI]
- ↑ Jha TK, Sundar S, Thakur CP et al., « Miltefosine, an oral agent, for the treatment of Indian visceral leishmaniasis », dans New Engl J Med, vol. 341, 1999, p. 1795–800
- ↑ Badaro R, Lobo I, Munõs A, et al., « Immunotherapy for drug-refractory mucosal leishmaniasis », dans J Infect Dis, vol. 194, 2006, p. 1151–59 [texte intégral]
- ↑ Ivens AC, et al., « The genome of the kinetoplastid parasite, Leishmania major », dans Science, vol. 309, no 5733, 2005, p. 436–42
- Portail de la médecine
Catégories : Maladie infectieuse tropicale | Infection parasitaire | Infection en dermatologie | Parasitologie médicale
Wikimedia Foundation. 2010.