- Pipéridine
-
Pipéridine 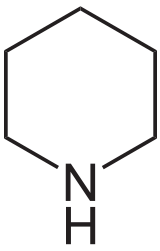
Structure de la pipéridine Général Nom IUPAC Pipéridine Synonymes Hexahydropyridine
Azacyclohexane
PentaméthylèneimineNo CAS No EINECS FEMA Apparence liquide incolore, d'odeur caractéristique[1]. Propriétés chimiques Formule brute C5H11N [Isomères] Masse molaire[3] 85,1475 ± 0,005 g·mol-1
C 70,53 %, H 13,02 %, N 16,45 %,Moment dipolaire 1,20 D [2] Diamètre moléculaire 0,546 nm [2] Propriétés physiques T° fusion -7 °C[1] T° ébullition 106 °C[1] Solubilité dans l'eau : miscible[1] Masse volumique 0,8606 g·cm-3 [4] Point d’éclair 16 °C (coupelle fermée)[1] Pression de vapeur saturante à 29,2 °C : 5,3 kPa[1] Point critique 47,6 bar, 320,85 °C [5] Thermochimie Cp Propriétés électroniques 1re énergie d'ionisation 8,03 ± 0,11 eV (gaz)[7] Propriétés optiques Indice de réfraction  1,452 [2]
1,452 [2]Précautions Directive 67/548/EEC 
T
FPhrases R : 11, 23/24, 34, Phrases S : (1/2), 16, 26, 27, 45, Transport - 2401 NFPA 704 SGH[8] 


DangerÉcotoxicologie LogP 0,84[1] Unités du SI & CNTP, sauf indication contraire. La pipéridine ou hexahydroazine est un composé organique de formule brute C5H11N. C'est une amine hétérocyclique avec un cycle saturé à six atomes, contenant cinq carbones et un azote. Elle se présente sous la forme d'un liquide clair avec une odeur poivrée. Elle a des propriétés de base faible et est souvent utilisée comme solvant en synthèse organique.
La pipéridine est un motif structural présent dans de nombreux alcaloïdes comme la pipérine ou la quinine, et c'est le principe actif du poivre, dont elle tire son nom. On retrouve le motif structural correspondant à la pipéridine dans de nombreux produits pharmaceutiques comme le raloxifène ou le fentanyl.
La pipéridine est inscrite au tableau II de la convention des Nations Unies contre le trafic illicite des stupéfiants, car c'est un précurseur utilisé dans la fabrication clandestine de la phencyclidine (PCP, phényl-cyclohéxyl-pipéridine).
Utilisations en biochimie
La pipéridine est utilisée dans la synthèse peptidique sur support solide dans la stratégie FMOC ((fluorényl-méthoxycarbonyl). Le groupement FMOC qui protège l'amine de l'acide aminé, est enlevé par β-élimination dans les conditions basiques obtenues en présence de pipéridine. Cette méthode de déprotection est orthogonale avec celle utilisée pour les chaînes latérales, qui sont protégées par des groupements labiles en conditions acides (par exemple BOC).
Elle sert également dans la méthode de séquençage de l'ADN de Maxam et Gilbert. Après modification chimique sélective des différents types de bases nucléotidiques, la chaîne phosphodiester de l'ADN est coupée par l'action de la pipéridine.
Voir aussi
Références
- PIPERIDINE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, 1999, 239 p. (ISBN 0-471-98369-1)
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) J. G. Speight, Norbert Adolph Lange, Lange's handbook of chemistry, McGraw-Hill, 2005, 16e éd., 1623 p. (ISBN 0-07-143220-5), p. 2.289
- Properties of Various Gases sur flexwareinc.com. Consulté le 12 avril 2010
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 2, Huston, Texas, Gulf Pub. Co. (ISBN 0-88415-858-6)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
Catégories :- Produit chimique toxique
- Produit chimique facilement inflammable
- Produit chimique corrosif
- Pipéridine
Wikimedia Foundation. 2010.




