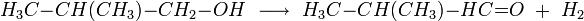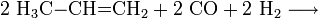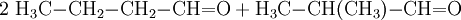- Méthylpropan-1-ol
-
2-méthylpropan-1-ol
2-méthylpropan-1-ol 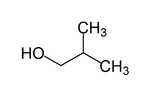
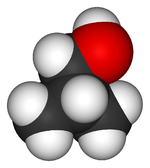
structure du 2-méthylpropan-1-ol Général Nom IUPAC 2-méthylpropan-1-ol Synonymes isobutanol
Carbinol isopropylique
Alcool isobutyliqueNo CAS No EINECS FEMA SMILES InChI Apparence liquide incolore, d'odeur caractéristique[1]. Propriétés chimiques Formule brute C4H10O [Isomères] Masse molaire 74,1216 g∙mol-1
C 64,82 %, H 13,6 %, O 21,59 %,Propriétés physiques T° fusion -108 °C[1] T° ébullition 108 °C[1] Solubilité dans l'eau à 20 °C : 8.7 g/100 ml[1] Masse volumique (eau = 1) : 0.8[1] T° d’auto-inflammation 415 °C[1] Point d’éclair 28 °C c.f.[1] Limites d’explosivité dans l’air en volume % dans l'air : 1.7-10.9[1] Pression de vapeur saturante 12 mbar à 20 °C
22 mbar à 30 °C
73 mbar à 50 °CPrécautions Directive 67/548/EEC 
XiPhrases R : 10, 37/38, 41, 67, Phrases S : (2), 7/9, 13, 26, 37/39, 46, Transport 30 1212 NFPA 704 SIMDUT[2] 

SGH[3] 

DangerÉcotoxicologie DL50 2 460 mg/kg (Rat, orale)
3 400 mg/kg (Lapin, cutanée)
3 040 mg/kg (Lapin, orale)CL50 Souris: 15 500 mg/m³ pour 4 heures
Rat: 19 200 mg/m³ pour 4 heures
Cobaye: 19 900 mg/m³ pour 4 heuresLogP 0.8[1] Unités du SI & CNTP, sauf indication contraire. Le 2-méthylpropan-1-ol, méthylpropan-2-ol, ou isobutanol, est un alcool primaire de formule brute C4H10O. C'est un des isomères du butanol. Il est très utilisé comme solvant lors des réactions chimiques, mais aussi comme réactif en synthèse organique.
L'isobutanol est produit naturellement lors de la fermentation des glucides. C'est aussi un sous-produit de la décomposition de matières organiques.
Sommaire
Utilisations
En synthèse
La principale utilisation en synthèse de l'isobutanol est son estérification, notamment en acétate d'isobutyle :
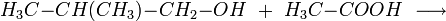
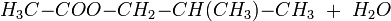
L'acétate de d'isobutyle sert alors dans la production de laques et autres revêtements, ainsi que dans l'industrie agro-alimentaire, comme arôme artificiel. D'autres esters de l'isobutanol comme le phtalate de diisobutyle (DIBP) sont utilisés comme agents plastifiants dans les plastiques, caoutchouc, etc.L'isobutanol peut aussi être oxydé en 2-méthylpropanal:
Directe
L'isobutanol peut être inclus dans les solvants de peinture, les décapants de vernis ou d'encre. En petite quantité dans les peintures, il réduit leur viscosité, améliore la glisse de la brosse et retarde l'apparition de résidus d'huile (le "blush") sur les surfaces peintes.
Il a d'autres utilisation plus mineures, comme par exemple additif à l'essence pour les moteurs à allumage commandé, dans laquelle il contribue à prévenir le givrage du carburateur, ou encore dans les polisseurs et nettoyants. Il est utilisé comme solvant d'extraction dans la production de composés organiques, et comme phase mobile en chromatographie sur couche mince.
Propriétés physico-chimiques
Le 2-méthylpropan-1-ol est un liquide incolore, d'odeur douce assez caractéristique. Comme tous les butanols il est inflammable. Il est soluble dans la plupart des solvants organiques éther-oxydes, alcools, aldéhydes, cétones, etc., mais est relativement peu soluble dans l'eau.
Production et synthèse
L'isobutanol peut être biosynthétisé par des micro-organismes.
Chimiquement, l'isobutanol peut être synthétisé, comme le butan-1-ol par hydroformylation du propène.
On réduit ensuite le 2-méthylpropanal (et non le butanal, comme dans la synthèse du butan-1-ol) obtenu par hydroformylation:
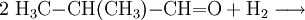
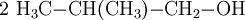
Articles connexes
Références
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « Isobutanol ».
- (de) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en allemand intitulé « 2-Methyl-1-propanol ».
- fiche du Service du répertoire toxicologique
- ↑ a , b , c , d , e , f , g , h et i ISOBUTANOL, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Alcool isobutylique » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Portail de la chimie
Catégories : Produit chimique irritant | Alcool (chimie)
Wikimedia Foundation. 2010.