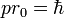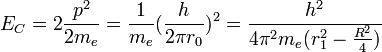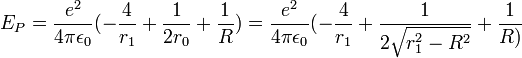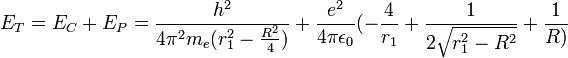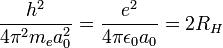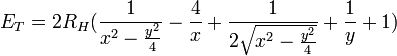- Liaison atomique
-
Liaison chimique
 Pour les articles homonymes, voir Liaison.
Pour les articles homonymes, voir Liaison.La liaison chimique est le phénomène physique qui lie les atomes entre eux en échangeant ou partageant un ou plusieurs électrons ou par des forces électrostatiques. Des liaisons fortes existent dans les molécules, les cristaux ou dans les solides métalliques et elles organisent les atomes en structures organisées. Les liaisons plus faibles sont expliquées, en général, par des polarités entre des molécules. Des polarités induites peuvent aussi provoquer des interactions très faibles comme les forces de London qui font partie des forces de van der Waals De telles forces permettent la liquéfaction ou la solidification de gaz tel que l'helium ou l'argon.
Survol
D'une manière simplifiée dans une liaison covalente, un électron ou une paire d'électrons peuvent être situés dans l'espace se trouvant entre deux noyaux atomiques, parce que dans cette région les électrons négatifs sont soumis à la charge positive de chaque noyau au lieu de la charge seulement de l'un d'eux. En même temps, les électrons présents entre les noyaux empêchent la répulsion entre ceux-ci et font que ces noyaux soient attirés vers les électrons qui sont plus proches et ainsi vers l'autre atome au lieu d'être repoussé par celui-ci. Cette situation tend à maintenir le noyau et les électrons dans une configuration relativement fixe bien qu'ils soient libres de se mouvoir en accord avec les contraintes de la mécanique quantique. De la même manière, en simplifiant, dans une liaison ionique, un ou plusieurs électrons sont simplement transférés d'un atome à l'autre faisant qu'un des atomes devienne un ion positif et l'autre d'un ion négatif. La liaison est donc due à une attraction électrostatique entre les atomes. Cette description est très simplifiée. La raison pour laquelle un atome transfère un électron vers un autre est un sujet compliqué qui implique la théorie des quanta.
En théorie, toute liaison peut être expliquée par la théorie des quanta mais, en pratique, les liaisons chimiques sont divisées en plusieurs catégories comme les deux citées plus haut. Des simplifications de la théorie des quanta ont été formulées pour décrire et prédire les liaisons et leurs propriétés. Parmi ces théories, nous avons, la Règle de l'octet, la théorie des liaisons de valence, la théorie de l'hybridation des orbitales, la théorie VSEPR, la théorie de champs de ligands et la méthode LCAO. Des théories électrostatiques et d'autres théories physiques sont utilisées pour décrire les polarités des liaisons et leurs effets sur les substances chimiques. Les liaisons chimiques réelles ne sont pas exactement décrites par ces théories à cause du principe d'incertitude. Cependant, dans leur ensemble, elles constituent un outil puissant qui peut être appliqué dans presque toute la chimie. En mécanique quantique, en termes simplifiés, les électrons sont localisés sur une orbitale atomique mais, dans une liaison chimique, ils forment une orbitale moléculaire.
L'orbitale peut être
- liante ; dans ce cas, les électrons de liaison ont la plus grande probabilité de se trouver entre les noyaux qu'ailleurs ; l'orbitale tend alors à maintenir les noyaux ensemble
- non-liante: dans ce cas, les électrons ont plus de probabilité de se trouver plus près d'un des noyaux, l'orbitale tend à défavoriser la liaison.
De plus, les orbitales moléculaires sont classées en fonction du type d'orbitales atomiques hybridées pour former la liaison. Ces orbitales atomiques sont dues aux interactions electron-noyau causées par des forces électromagnétiques. Des substances chimiques formeront un lien si leurs orbitales abaisseront leur énergie lorsqu'elles interagiront l'une avec l'autre. Il y a différentes liaisons chimiques en fonction de la forme du nuage électronique et de leurs niveaux d'énergie.
Histoire
Les premières pensées sur la nature de la liaison chimique depuis le début du XIIe siècle supposaient que certains types d'espèces chimiques étaient liés par certains types d'affinité chimique.
Au milieu du XIXe siècle, Edward Frankland, F.A. Kekule, A.S. Couper, A.M. Butlerov et Hermann Kolbe, construisant la théorie des radicaux, développèrent la théorie des valences, appelée au départ de "pouvoir de combiner" dans laquelle les composés étaient liés grâce à l'attraction de pôles positif et négatif.
En 1916, le chimiste Gilbert Lewis développa l'idée de la liaison par paire d'électrons. Walter Heitler et Fritz London sont les auteurs de la première explication par la mécanique quantique de la liaison chimique, spécialement celle de l'hydrogène moléculaire, en 1927, utilisant la théorie de liaisons de valence. En 1930, la première description mathématique quantique de la liaison chimique simple fut développée dans la thèse de doctorat de Edward Teller.
In 1931, le chimiste Linus Pauling publia ce qui est parfois considéré comme le texte le plus important de l'histoire de la chimie : “On the Nature of the Chemical Bond”.
Dans ce papier basé sur les travaux de Lewis, Heitler et London, et sur son propre travail, il présente six règles pour la liaison avec électron partagé; les trois premières étaient généralement connues :
- la liaison par partage d'électrons se forme par l'interaction d'un électron célibataire de chacun des deux atomes
- les spins des deux électrons doivent être opposés
- une fois accouplés, les deux électrons ne peuvent pas entrer dans une autre liaison
Ses trois autres règles étaient nouvelles :
- l'échange d'électrons pour la liaison comprend une seule fonction d'onde pour chaque électron
- les électrons disponibles dans le niveau d'énergie inférieur forment les liaisons les plus fortes
- de deux orbitales d'un atome, c'est celle qui peut se superposer le plus à l'orbitale d'un autre atome qui formera la liaison la plus forte
Calcul de la molécule d'hydrogène
Le premier calcul d'une liaison chimique, fondateur de la Chimie quantique est celui de la molécule la plus simple, celle de l'hydrogène par Bohr en 1913[1]. C'est sans doute le seul calcul de liaison chimique accessible à un non-spécialiste.
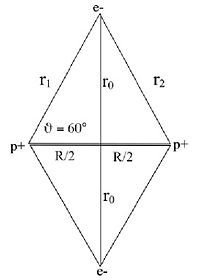
Il consiste à appliquer le modèle de Bohr de l'atome à une molécule. On fait l'hypothèse que les électrons ont un mouvement circulaire de rayon r0 autour de l'axe des protons p+p+, supposés immobiles et distants de R. La distance électron-proton e-p+ est r1. En utilisant la formule du modèle de Bohr de l'atome pour l’état fondamental :
où p=mv est la quantité de mouvement et
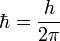 la constante de Planck réduite, l'énergie cinétique des électrons s'écrit :
la constante de Planck réduite, l'énergie cinétique des électrons s'écrit :Le potentiel V est attractif entre électrons et protons et se compose des quatre liaisons électron-proton. Il y a répulsion entre les électrons distants de 2r0 et les protons distants de R. L'énergie potentielle s'écrit:
L'energie totale est:
Dans un atome d’hydrogène, l’égalité entre la force électrostatique et la force centrifuge peut s’écrire :
où
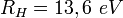 est la constante de Rydberg,
est la constante de Rydberg, 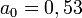 Å le rayon de Bohr de l'atome d'hydrogène et ε0 la constante diélectrique.
Å le rayon de Bohr de l'atome d'hydrogène et ε0 la constante diélectrique.En y retranchant l’énergie de liaison − 2RH de deux atomes d’hydrogène isolés, l’énergie totale de la molécule devient :
où x = r1 / a0 et y = R / a0.
Cette équation se résout graphiquement en faisant varier x de telle façon que l'énergie du minimum soit minimale. On obtient ainsi x = 1,15 et y = 2,7 ce qui donne les valeurs trouvées par Bohr en 1913 de 2,7 eV pour l’énergie de liaison et de 0,6 Å pour l'écartement des protons. La précision du calcul est certes médiocre puisque les valeurs expérimentales sont, respectivement de 4,5 eV et de 0,74 Å. On trouvera des méthodes plus perfectionnées basées sur les orbitales moléculaires.
Liaisons dans les formules chimiques
longueur de liaisons en pm
et énergies de liaison en kJ/mol.
La longueur des liaisons peut être convertie en Å
en divisant par 100 (1 Å = 100 pm).
Source [2].Liaison Longueur
(pm)Energie
(kJ/mol)H — Hydrogène H–H 74 436 H–C 109 413 H–N 101 391 H–O 96 366 H–F 92 568 H–Cl 127 432 H–Br 141 366 C — Carbone C–H 109 413 C–C 154 348 C=C 134 614 C≡C 120 839 C–N 147 308 C–O 143 360 C–F 135 488 C–Cl 177 330 C–Br 194 288 C–I 214 216 C–S 182 272 N — Azote N–H 101 391 N–C 147 308 N–N 145 170 N≡N 110 945 O — Oxygène O–H 96 366 O–C 143 360 O–O 148 145 O=O 121 498 F, Cl, Br, I — Halogènes F–H 92 568 F–F 142 158 F–C 135 488 Cl–H 127 432 Cl–C 177 330 Cl–Cl 199 243 Br–H 141 366 Br–C 194 288 Br–Br 228 193 I–H 161 298 I–C 214 216 I–I 267 151 S — Soufre C–S 182 272 Article détaillé : Représentation des molécules.Comme les atomes, les molécules et leurs orbitales sont tridimensionnels, il est difficile d'utiliser des techniques simples pour les représenter. Dans les formules moléculaires, la liaison chimique (orbitale liante) entre deux atomes est indiquée de différentes manières selon les nécessités.
Parfois, elle est totalement ignorée. Par exemple, en chimie organique, les chimistes sont parfois intéressés par le groupe fonctionnel de la molécule . Ainsi, selon la nécessité, la formule moléculaire de l'éthanol peut être écrite sur le papier
- selon la configuration,
- en trois dimensions,
- en deux dimensions pleines (indiquant chaque liaison sans les directions tridimensionnelles),
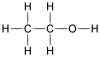
- en deux dimensions comprimées (CH3-CH2-OH),
- en séparant le groupe fonctionnel du reste de la molécule (C2H5OH), ou
- par constituants atomiques (C2H6O).
Parfois, même le nuage d'électrons non-liant est indiqué. (avec les directions en 2 dimensions approximative. Par exemple le carbone élémentaire:: .'C.' Certains chimistes indiquent aussi les orbitales ; par exemple, l'hypothétique anion ethene-4 (\/C=C/\ -4) indiquant la possibilité de formation de liaison.
Les liaisons chimiques fortes
Ces liaisons chimiques sont des forces intramoléculaires qui maintiennent les atomes ensemble dans les molécules et les solides. Ces liaisons peuvent être simples, doubles ou triples c'est-à-dire que le nombre d'électrons participants ( ou contenus dans l'orbitale de liaison) est de deux, quatre ou six. Un nombre pair d'électrons est habituel parce que les électrons appariés ont une énergie inférieure. En fait, des théories plus avancées sur les liaisons montrent que les liens ne sont pas toujours provoqués par un nombre entier d'électrons et, ce, dépendant de la distribution de ceux-ci dans chaque atome concerné dans la liaison. Par exemple, les carbones dans le benzène sont liés l'un à l'autre par environ 1,5 liaisons et les deux atomes dans l'oxyde nitrique NO sont connectés par environ 2,5 liaisons. Des liaisons quadruples ne sont pas impossibles mais sont très rares.
Le type de liaison dépend de la différence d'électronégativité et de la distribution des orbitales possibles dans les atomes liés. Plus l'électronégativité est importante, plus l'électron est attiré par un atome particulier et plus la liaison a un caractère ionique. Si l'électronégativité est faible, la liaison est covalente.
Liaison covalente
Article détaillé : Liaison covalente.La liaison covalente est le type commun de liaison où la différence d'électronégativité entre les atomes liés est petite ou nulle. Dans ce dernier cas, on parle parfois de liaison purement covalente. Voir les articles Liaison σ et Liaison π pour l'explication CLOA habituelle des liaisons non-polaires.
Liaison covalente polaire
La liaison covalente polaire est par nature un type intermédiaire de liaison entre la liaison covalente et la liaison ionique. Dans des théories plus avancées, on considère que toutes les liaisons sont de ce type.
Liaisons ioniques
Article détaillé : Liaison ionique.La liaison ionique est un type d'interaction électrostatique entre atomes dont la différence d'électronégativité est supérieure à 1,6 ( cette limite est conventionnelle). Avec une telle différence d'électronégativité, le transfert électronique est considéré comme total, l'atome le plus électronégatif devient un anion et le plus électropositif un cation. Il existe des ions polyatomiques qui portent une charge électrique et contiennent par ailleurs des liaisons covalentes entre les atomes les constituant. Les charges ioniques, en général, ont des valeurs entre -4e et +7e.
Liaison covalente coordinative
Article détaillé : Liaison covalente.La liaison covalente coordinative est une liaison spéciale dans laquelle les électrons de liaison proviennent d'un seul des atomes, mais sont approximativement partagés également par les deux dans une orbitale. Cette configuration est différente d'une liaison ionique avec faible différence d'électronégativité.
Ions polyatomiques
Un type différent de liaisons entre deux ou plus d'atomes apparaissent dans les ions. La liaison est située au cœur des trois (ou plus) atomes.
Liaisons chimiques comprenant plus de deux atomes
Liaison aromatique
Article détaillé : Hydrocarbure aromatique.Souvent les orbitales ont une forme et une densité complexes et très souvent la position des électrons ne peut pas être réduite à de simples traits (localisation de deux électrons) ou des points (localisation d'un électron). C'est le cas lorsque le composé obéit à la règle de Hückel (règle des 4n +2). Dans le benzène, le composé aromatique exemple, 18 électrons de liaison relient 6 carbones pour former un anneau plane. L'ordre de liaison (moyenne du nombre de liaisons) entre les différents carbones peut être considéré comme (18/6)/2=1.5 mais dans ce cas toutes les liaisons sont identiques du point de vue chimique. Elles peuvent parfois être comme de simples liaisons alternant avec des doubles liaisons, mais il est plus correct de dire que toutes les liaisons sont équivalentes de valeur. Dans le cas de composé aromatique hétérocyclique et de benzène substitué, les différences d'électronégativité des parties de l'anneau influencent le comportement chimique qui sinon serait équivalent.
Liaison métallique
Article détaillé : Liaison métallique.Une liaison métallique n'existe que dans un solide ( ou à l'état liquide) tout comme la liaison ionique. Dans la liaison métallique, les électrons sont mobiles dans tout un réseau alors que dans une liaison ionique, les charges sont presque statiques.
Liaisons intermoléculaires
Liaison hydrogène
Article détaillé : Liaison hydrogène.La liaison hydrogène (HB) ou pont hydrogène est une liaison de faible intensité qui relie les molécules. Elle implique un atome d'hydrogène et un atome assez électronégatif (comme l'oxygène par exemple).
Liaison halogène
Article détaillé : Liaison halogène.La liaison halogène (XB) est une liaison de faible intensité qui peut se former entre un atome d'halogène déficient en densité électronique (acide de Lewis)(I > Br > Cl > F)et un autre atome riche en électron (O = N > S) (base de Lewis). On trouve un grand nombre d'exemples de liaisons halogènes dans les systèmes biologiques. Par exemple, l'interaction entre la thyroxine et son récepteur est du type liaison halogène.
Liaison de van der Waals
Article détaillé : Force de van der Waals.La liaison de van der Waals est une interaction de faible intensité entre atomes, molécules, ou une molécule et un cristal. Elle est due aux interactions entre les moments dipolaires électriques des deux atomes mis en jeu. Aucun électron n'est mis en commun entre les deux atomes.
Interactions entre cations et liaisons pi
Électrons dans les liaisons chimiques
Limitation de la théorie de liaisons de valence
Détermination des propriétés chimiques
Notes et références
Articles connexes
- Liaison covalente :
- Liaison à un électron
- Liaison à trois centres et deux électrons
- Liaison à trois électrons
- Liaison à trois centres et quatre électrons
- Liaison hydrogène
- Liaison halogène
- Liaison ionique
- Liaison métallique
- Liaison de van der Waals
- Énergie de liaison nucléaire
Liens externes
- Liste des différentes liaisons, classés par éléments.
- (fr) Site éducatif sur la chimie | tiré de l'ensemble www.educations.net
- Portail de la chimie
- Portail de la physique
Catégorie : Liaison chimique
Wikimedia Foundation. 2010.