- Kératine 8
-
La kératine 8 est une protéine cytoplasmique qui constitue les filaments intermédiaires au niveau des tissus épithéliaux à simple couche.
Sommaire
Description
Trois constituants forment le cytosquelette, les microfilaments, les microtubules et les filaments intermédiaires. Les filaments intermédiaires sont codés par 67 gènes distincts et existent en six sous-types, qui sont des polymères en super hélice de différents types de protéines fibrillaires (kératines de type acide, kératines de type basique, vimentine et apparentés, neurofilaments, lamines ainsi que des protéines fibrillaires en rapport avec les cellules gliales)[1].
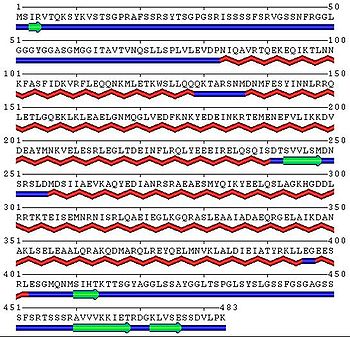
La kératine 8 est une protéine cytoplasmique qui constitue les filaments intermédiaires au niveau des tissus épithéliaux à simple couche. Il s’agit d’une cytokératine de type II basique qui s’associe de façon non covalente en hétérodimère insoluble, avec la cytokératine 18 de type I acide. Chez l’humain, son gène est situé sur le chromosome 12 et est composé d’environ 9,8 kpb. La protéine encodée possède 483 acides aminés, a un poids moléculaire de 53,7 kDa et son point isoélectrique est situé à 5,6[2],[3].
Structure moléculaire
Du point de vue de sa structure, la kératine 8 est formée d’une portion centrale en hélice α, composée de quatre sous-domaines (1A, 1B, 2A et 2B) reliés entre eux par les portions (L1, L12 et L2). Pour s’agencer en dimère, la kératine 8 possède une forte homologie quant à la disposition de ces hélices α avec la kératine 18[4].
Modification post-transductionnelle
La kératine 8 possède trois sites majeurs de phosphorylation in vivo au niveau de ses régions globulaires. L’emplacement de ces sites renseigne grandement sur la spécificité d’action d’une telle modification. On suppose qu’en étant situé sur les extrémités de la protéine, la phosphorylation de ces sites entraînerait à la fois une réorganisation des filaments intermédiaires, un déplacement dans l’équilibre de la portion insoluble polymérisée vers l’état soluble dépolymérisée, une relocalisation de la protéine au niveau des différents organites, une association avec un membre de la famille de protéines 14-3-3 et serait associé à la protection contre différents stress physiologiques[5]. Le premier, situé au niveau de la sérine 23 dans la portion N-terminal de la protéine, est un site de phosphorylation extrêmement conservé chez les kératines de type II suggérant qu’il a une fonction commune à toutes ces types de protéines[2],[3],[5]. Le second site se situe au niveau de la sérine 431 dans la portion C-terminale de la protéine et a comme rôle d’augmenter la spécificité des autres sites de phosphorylation durant la mitose et l’exposition au facteur de croissance épidermique en association avec la réorganisation des filaments intermédiaires[2],[3],[5]. Le troisième site se situe au niveau de la sérine 73 dans la portion N-terminale et joue un rôle significatif dans la réorganisation des filaments[2],[3],[5]. Dans le foie, les hépatocytes n’expriment que la cytokératine 8 et son homologue, la cytokératine 18. Maintenant on comprend le caractère toxique conféré à l’alcool qui induit une hyperphosphorylation de ces sites ayant comme conséquence directe la désorganisation des filaments intermédiaires. Une telle désorganisation est à l’origine de lésions hépatiques retrouvées entre autres lors de cirrhose du foie alcoolique[4].
Fonctions de la protéine
La cytokératine 8 possède un rôle important dans le maintien de la polarité cellulaire. En effet, en l’absence de kératine 8, certains marqueurs apicaux des cellules de l’intestin et des hépatocytes ne sont pas présents. Ces éléments lient les cellules de la monocouche entre elles. Les jonctions adhérentes et les desmosomes permettent à l’épithélium simple de maintenir une polarité et les jonctions serrées imperméabilisent l’espace intercellulaire et permettent d’acquérir la fonction de barrière sélective[6].
De plus, la kératine 8 protège des stress chimiques[7], est une cible pour les caspases qui viennent cliver la kératine 18 dans l’initiation à l’apoptose[8] et désensibilise la signalisation pro-apoptotique des cellules en réponse à une stimulation du facteur de nécrose tumorale, produit direct des macrophages et lymphocytes T. La kératine 8 est attachée à la partie cytoplasmique des récepteurs membranaires TNFR1 et TNFR2. Il a été montré que les souris déficientes en kératine 8 étaient cent fois plus sensibles au facteur de nécrose tumorale[9].
Toutefois, la majeure partie des rôles de la kératine 8 sont encore à élucider, car les connaissances sur les filaments intermédiaires restent encore très peu élaborées.
Pathologies
L’étude des fonctions des kératines chez l’humain a aussi permis de découvrir plusieurs mutations qui semblent être associées à diverses maladies. Des mutations sur le gène de la kératine 8 sont associées à des patients souffrant de maladies inflammatoires du système digestif[10] et d’autres sont associées à des patients souffrant de cirrhoses du foie cryptogéniques[11]. De plus, le tissu épithélial est à l’origine d’environ 80 % des cancers humains, étant donné que ce dernier est régulièrement en contact avec des agents mutagènes, ce qui sollicite la division pour remplacer les cellules endommagées. Les kératines 8 et 18 sont exprimées dans plusieurs types de carcinomes dont ceux du sein, de la prostate, du poumon, du côlon et des ovaires[12]. Finalement, des modèles animaux ont aussi démontré qu’une absence ou une mutation dans le gène de la kératine 8 provoque l’apparition de maladie du foie. Comme par exemple des hémorragies chez la souris avant la naissance, une fragilité accrue des hépatocytes, des hépatites moyennes chroniques et des colites[11].
Notes et références
- http://fr.wikipedia.org/wiki/Filament_interm%C3%A9diaire
- KU N-O et all., Keratin 8 Phosphorylation by p38 Kinase Regulates Cellular Keratin Filament Reorganization, The journal of biological chemistry, vol. 277, No. 13, 2002, PMIB:11788583
- LIAO J., Sress, Apoptosis and Mitosis Induce Phosphorylation of Human Keratin 8 at Ser-73 in Tissues and Cultured Cells, The journal of Biological Chemistry, vol. 272, No. 28, 1997, PMIB:9211903
- http://archimede.bibl.ulaval.ca/archimede/files/42737491-ed74-4e4e-9593-3ff7bce34080/22343.html
- KU N-O et al., Phosphorylation of Human Keratin 8 in Vivo at Conserved Head Domain Serine 23 and at Epidermal Growth Factor-stimulated Tail Domain Serine 431, The Journal of Biological Chemistry, Vol. 272, No.11, 1997, PMID:9054461
- AMEEM A.N. et al., Anomalous apical plasma membrane phenotype in CK8-deficient mice indicates a novel role for intermediate filaments in the polarization of simple epithelia, Journal of Cell Science 114, 2000, PMID:11171325
- CADRIN M et al., Modifications in cytokeratin and actin in cultured liver cells derived from griseofulvin-fed mice, Laboratory Investigation; a journal of technical methods and pathology, vol.72, no.4 , 1995, PMID:7536860
- OSHIMA RG et al., Oncogenic regulation and function of keratins 8 and 18, Cancer Metastasis Review, 1996, PMID:9034603
- CAULIN C. et al., Keratin-dependent, Epithelial Resistance to Tumor Necrosis Factor-induced Apoptosis, The journal of cell biology, Vol.149, No.1,2000, PMID:10747083
- OWENS DW et al., Keratin mutations and intestinal pathology, The journal of pathology, 2004, PMID:15495267
- KU NO et al., Keratin 8 and 18 mutations are risk factors for developing liver disease of multiple etiologies, Proceedings of the national academy of sciences of the USA,vol.100, no.10,2003,PMID:12724528
- STIGBRAND T et al., Epitope specificity of 30 monoclonal antibodies against cytokeratin antigens: the ISOBM TD5-1 Workshop, Tumour biology : The Journal of the International Society for Oncodevelopmental Biology and Medecine, Vol.19, No.2, 1996, PMID:9486565
Wikimedia Foundation. 2010.