- Alliage métallique
-
Alliage
 Pour les articles homonymes, voir Alliage (homonymie).
Pour les articles homonymes, voir Alliage (homonymie).Un alliage est une combinaison d'un métal avec un ou plusieurs autres éléments chimiques.
Un métal pur a des caractéristiques mécaniques relativement faibles. Le fait d'ajouter d'autres éléments permet de « durcir » (augmenter les caractéristiques mécaniques). Également, ces ajouts permettent de modifier les caractéristiques chimiques des métaux (en particulier leur comportement à la corrosion) ou d'améliorer d'autres caractéristiques (facilité de mise en œuvre : coulabilité par exemple).
Le métal principal, la plus importante partie du mélange, est appelé « métal de base » ou « base ». Les éléments ajoutés volontairement sont appelés « éléments d'alliage » (ou d'addition) et les éléments non désirés sont appelés « impuretés ».
Les éléments d'alliages sont le plus souvent des métaux, mais peuvent également être d'autres éléments chimiques : le carbone dans l'acier ou la fonte, le silicium dans l'aluminium, etc.
Généralement, quand l'élément d'alliage n'est pas un métal, sa proportion reste faible. Ainsi, la concentration de carbone est inférieure à 2% en masse pour l'acier et inférieure à 7% en masse pour la fonte, alors qu'il est possible de faire un alliage cuivre zinc (laiton) avec 50% de chacun des éléments.
Un alliage peut être naturel, par exemple l'électrum, alliage d'or et d'argent natifs utilisé dans la Préhistoire et l'Antiquité : Varna, Asie Mineure, Ur, Égypte, etc.
Sommaire
Alliage binaire
Alliage binaire à une seule phase
Un alliage homogène est constitué d'une seule phase solide homogène. Pour obtenir un alliage homogène, il faut qu'il y ait miscibilité totale entre les éléments d'alliage. Il y a deux possibilités :
- Les deux éléments d'alliages sont solubles l'un dans l'autre quelles que soient leurs proportions respectives.
- La concentration de l'élément d'alliage est inférieure à la limite de solubilité.
Les règles de Hume-Rothery indiquent les conditions pour obtenir un alliage homogène avec solubilité totale à l'état solide.
Élément Rayon
atomiqueStructure
cristallineBismuth 160 pm Rhomboédrique Antimoine 145 pm Rhomboédrique Les alliages de bismuth et d'antimoine forment une solution solide (en dessous du solidus) dans tous les cas de figure et à toutes les températures. Le diagramme de phase est un diagramme à un fuseau.
Quelques autres couples dont la miscibilité est bonne et permet d’obtenir des solutions solides homogènes à toutes températures : cuivre-nickel, cuivre-palladium, Argent-or, argent-palladium, molybdène-vanadium, molydène-tungstène, etc.
Certains alliages binaires solubles présentent aux plus basses températures un défaut de solubilité. Il apparaît sur le diagramme de phase un secteur où cohabitent deux phases, la première étant constituée d'une solution solide saturée de B dans A, la deuxième inversement de A dans B. C'est le cas par exemple du système cuivre-nickel qui présente en dessous de 322 °C une zone avec deux phases 1 et 2.
Alliage binaire à plusieurs phases
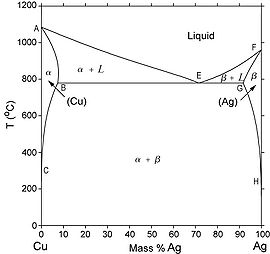
Un autre type de diagramme de phase binaire commune et relativement simple trouvé pour alliages est un diagramme de phase binaire eutectique. Un certain nombre de caractéristiques de ce diagramme de phase est important et mérite d'être signalé. Tout d'abord, trois monophasé régions sont disponibles sur le schéma: α, β et liquide. À la figure à gauche la α est une phase de solution solide riche en cuivre, il a l'argent que le soluté et une composante CFC de structure cristalline. La phase β (solution solide) aussi a une structure CFC, mais le cuivre est le soluté. Les phases α et β sont considérés d'inclure le cuivre pur et d'argent pur, respectivement.
Ainsi, la solubilité dans chacune de ces phases solides est limitée, en ce que, à tout température en dessous de la ligne BEG, il est limité la concentration d'argent qui peut se dissoudre dans le cuivre (pour la phase α), et de même façon pour le cuivre en argent (pour la phase β). Le limite de solubilité de la phase α correspond à la ligne de démarcation, marqué CBA.
À des températures inférieures à 779oC (1434oF), la ligne de limite de solubilité solide qui sépare la phase α et la phase α + beta régions est appelé une ligne Solvus, la frontière entre le champ α et le champ α + L est la ligne de solidus (AB). Pour la phase β, deux lignes de solidus et Solvus existent également, HG et GF, respectivement. La ligne horizontale BEG, qui est parallèle à l'axe de composition et s'étend entre le maximum de solubilité de ces positions, peut aussi être considéré comme une ligne solidus, elle représente la température la plus basse à laquelle une phase liquide peut exister pour tout alliage de cuivre-argent qui est à l'équilibre.
Il y a aussi trois régions de deux phases trouvés dans le système cuivre-argent. Comme l'argent est ajouté au cuivre, la température à laquelle les alliages devenent totalement liquide diminue au long de la ligne liquidus (ligne AE); ainsi, la température de fusion du cuivre est réduit par l'argent des ajouts. C'est le même pour l'argent: l'introduction de cuivre réduit la température de fusion complète au long de la ligne liquidus FE. Ces lignes liquidus répondre au point E sur le diagramme de phase, par le biais de qui passe également la ligne horizontale isotherme BEG. Point E est le point eutectique, qui est désigné par la composition CE et de la température TE; pour la système cuivre-argent, les valeurs de la CE et TE sont 71,9 wt% Ag et 779oC (1434oF), respectivement.
Une importante réaction a lieu dans un alliage de composition «CE» cependant elle change la température en passant par TE. Sur le refroidissement, une phase liquide est transformé en deux phases solides (α et β) à la température TE, la réaction inverse se produit sur le échauffement . C'est ce qu'on appelle une réaction eutectique (eutectic signifie facilement fondu), et CE et TE représentent les composition et température eutectiques, respectivement. Souvent, la ligne solidus horizontale à TE est appelé isotherme eutectique. La réaction eutectique, sur le refroidissement, est similaire à la solidification des composants purs en ce que la réaction à terme à une température constante, ou isométriquement, à TE. Toutefois, le produit solide de la solidification eutectique est toujours deux phases solides, alors que pour un simple composant, une seule phase se forme. A cause de cette réaction eutectique, les diagrammes de phase similaires à ceux de la figure du diagramme Ag-Cu sont qualifiées de diagrammes de phase eutectiques.
Dans la construction de diagrammes de phases binaires, il est important de comprendre que un ou au maximum deux phases peuvent être en équilibre dans une région de phase. Pour un système eutectique, trois phases (α, β et L) peuvent être en équilibre, mais seulement à points au long de la ligne eutectique.[1]
Il y a des milliers de combinaisons possibles pour diagrammes de phases avec plusieurs phases. Certaines des principales caractéristiques des diagrammes de phases comprennent points congrus, où une phase solide se transforme directement en liquide. Il y a aussi le peritectoid, un point où les une solide se trasnforme en une phase liquide et une autre phase solide lors du chauffage. L'inverse de cela, lorsque un phase solide se transforme en deux phases solides au cours de chauffage, est appelé le eutectoïdes.
Un diagramme de phase complexe d'une grande importance technologique est celle de la fer-carbone système de moins de 7% de carbone.
L'axe des X d'un tel schéma correspond à la concentration variable du mélange. Comme les mélanges sont généralement loin d'affaiblir et leur densité en fonction de la température est généralement inconnu, la mesure préféré est concentration molaire. Un basé sur le volume de mesure comme molarité serait déconseillé.
Structure
Alliage homogène
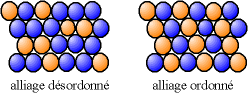
Un alliage homogène peut être ordonné (les atomes de différentes natures suivent une alternance stricte) ou désordonné (les différents atomes occupent des places aléatoires).
En général, on a un métal majoritaire, les autres métaux sont appelés « éléments d'alliage ». Les atomes des éléments d'alliage peuvent prendre la place des atomes du métal majoritaire, on parle alors de « substitution » ; ils peuvent aussi se glisser entre les atomes de l'alliage majoritaire, on parle d'« insertion ». Lorsqu'un métal est présent en faible teneur dans un alliage, on parle souvent de solution solide.
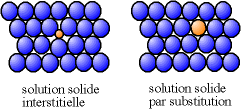
Alliage hétérogène
Lorsque la teneur en élément d'alliage augmente, on peut avoir formation de deux phases : une phase contenant peu d'éléments d'alliage, et une phase à forte teneur en éléments d'alliage. Les cristallites à forte teneur sont appelés « précipités ».
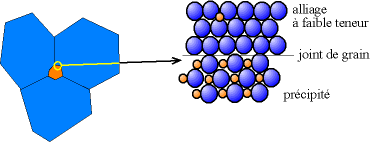
Les précipités sont souvent des alliages ordonnés, que l'on appelle « intermétalliques ». Les intermétalliques ainsi formés sont parfois par la suite étudiés en tant qu'alliages propres, comme un nouveau matériau, et on essaie d'en produire en tant que tel et non plus en tant que précipités.
Exemples
Principaux alliages
Alliages de fer
-
-
- fonte : fer + carbone (à plus de 2,1% et jusqu'à 6,7% en masse de carbone)
- acier : fer + carbone (à moins de 2,1% en masse de carbone)(+ des traces éventuelles de Ni,Cr,Mo en faible pourcentage (<4%))
- acier inoxydable : fer + carbone + nickel + chrome, et parfois , molybdène, vanadium
- cuani : (2,7 de fonte et 2,8 de nickel)
-
Alliages de cuivre
Alliages d'aluminium
Ils sont aussi appelés alliages légers
Pour plus de détail voir les deux articles ci-dessous :
Alliages moins connus
- alliage plomb-étain : pour la soudure
- amalgame : mercure + un autre métal, par exemple or ou cuivre ; le terme désigne également un mélange de métaux utilisé pour les soins dentaires (« plombage »)
- maillechort : cuivre + zinc + nickel
- monel® (nom commercial) : nickel + cuivre
- régule : étain ou plomb + antimoine
- zamak : zinc + aluminium + magnésium + cuivre et autres « ZL » (composant principaux : zinc et aluminium)
Alliages pour des applications spécifiques
- ferrotitanes : fer + 25 à 70%m de Ti + 4 à 10%m d'aluminium
- TA6V : titane + 6%m aluminium + 4%m vanadium, très utilisé dans l'industrie aéronautique[note 1].
- MCrAl : métal + chrome + aluminium + parfois de l'yttrium (MCrAlY), alliages réputés pour leur bonne tenue mécanique et résistance à la corrosion à haute température)
- FeCrAl : fer + chrome + aluminium
- NiCrAl : nickel + chrome + aluminium
- superalliages à base nickel (par exemple les inconels) : bonne tenue mécanique et résistance à la corrosion à haute température
- intermétalliques : alliages ordonnés, respectant une stœchiométrie précise (mais des écarts à la stœchiométrie sont tolérés)
- NiAl β : 50%at nickel + 50%at aluminium
- FeAl B2 : 50%at fer + 50%at aluminium
- TiAl : 50%at titane + 50%at aluminium
- Les alliages présentant de faibles coefficients de dilatation (créés par Charles Édouard Guillaume)
- Invar (36% de nickel, 0,4% de manganèse, 0,1% de carbone, 63,5% de fer)
- élinvar (Nivarox, Métélinvar, Isoval) (nickel, chrome, fer)
- FeNiCo : le Kovar, un alliage fer / nickel / cobalt destiné au scellement verre/métal ou céramique/métal
Références
- ↑ Fundamentals of Materials Science and Engineering / William D. Callister Jr. Wiley editor. 2001 pp 292-295
Notes
- ↑ La désignation usuelle française TA6V est basée sur l'ancienne norme NF A 02-004 aujourd'hui annulée, sa désignation chimique est Ti Al 6 V.
Voir aussi
Articles connexes
- Portail de la chimie
- Portail de la physique
Catégorie : Alliage
Wikimedia Foundation. 2010.