- Hypochlorite de sodium
-
Hypochlorite de sodium 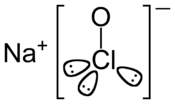
Structure de l'hypochlorite de sodium Général Nom IUPAC Hypochlorite de sodium No CAS No EINECS PubChem SMILES InChI Apparence solide blanc Propriétés chimiques Formule brute NaClO Masse molaire[1] 74,442 ± 0,002 g·mol-1
Cl 47,62 %, Na 30,88 %, O 21,49 %,Propriétés physiques T° fusion 18 °C Solubilité 293 g·l-1 à 0 °C; 799 g·l-1 à 25 °C dans l'eau Précautions Directive 67/548/EEC[2] 
C
NPhrases R : 31, 34, 50, Phrases S : (1/2), 28, 45, 50, 61, Transport[2] 80 1791 SIMDUT[3] 


SGH[4],[2] 

DangerInhalation Dangereuse, peut être mortelle Peau Irritant, provoque des brûlures,
peut être mortelYeux Irritant, provoque des brûlures Ingestion dangereuse, voire mortelle intraveineuse Irritant, provoque des infections Unités du SI & CNTP, sauf indication contraire. L’hypochlorite de sodium est un composé chimique de formule brute NaClO. C'est un solide blanc très instable couramment utilisé en solution aqueuse comme agent désinfectant, notamment sous forme d'eau de Javel pour un usage domestique. Sous forme solide anhydre, il tend à se dismuter en oxygène O2, chlorure de sodium NaCl et chlorate de sodium NaClO3 :
Dans l'eau de Javel, l'hypochlorite de sodium est mélangé avec du chlorure de sodium résultant de sa fabrication par l'action de chlore Cl2 sur une solution d'hydroxyde de sodium NaOH électrolysée entre deux électrodes rapprochée en dessous de 40 °C, afin d'éviter la formation de chlorate de sodium NaClO3 :
Réactions
L'hypochlorite de sodium réagit progressivement avec les métaux en donnant l'hydroxyde ou l'oxyde de ce métal, par exemple ici avec le zinc :
Il libère du chlore Cl2 avec l'acide chlorhydrique HCl :
Avec les autres acides, il libère l'acide hypochloreux HClO, par exemple ici avec l'acide acétique CH3COOH :
Sous l'effet de la chaleur ou de la dessiccation, il se dismute en chlorure de sodium NaCl et chlorate de sodium NaClO3 ou en oxygène O2 :
La réaction — violente — avec le peroxyde d'hydrogène H2O2 libère de l'oxygène singulet 1O2, défini par une configuration électronique particulière, notée 1Δg :
Avec l'ammoniaque NH4OH, la réaction conduit à la formation d'hydroxyde de sodium NaOH et de monochloramine NH2Cl, toxique :
L'hypochlorite de sodium rend l'eau de Javel dangereuse lorsqu'elle est en contact avec d'autres produits d'entretien ou divers produits d'utilisation domestique (par exemple des tensioactifs, des parfums d'intérieur, ...), car c'est un réactif instable qui forme facilement des composés nocifs, notamment des composés organiques volatils chlorés, avec de nombreuses substances de la vie quotidienne.
Références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Entrée de « Sodium hypochlorite; solution ... percent Cl active » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 13 avril 2011 (JavaScript nécessaire)
- « Hypochlorite de sodium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
Catégories :- Composé du sodium
- Produit chimique corrosif
- Produit chimique dangereux pour l'environnement
- Produit chimique comburant
- Hypochlorite
- Solution
Wikimedia Foundation. 2010.

