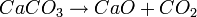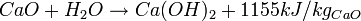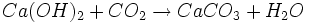- Hydroxyde de Calcium
-
Chaux (matière)
 Pour les articles homonymes, voir Chaux.
Pour les articles homonymes, voir Chaux.La chaux est une matière généralement poudreuse et de couleur blanche, obtenue par combustion du calcaire. Elle est utilisée depuis l'Antiquité, notamment dans la construction.
Chimiquement, c'est un oxyde de calcium avec plus ou moins d'oxyde de magnésium mais la désignation usuelle de chaux peut englober différents états chimiques de ce produit. On les distingue notamment dans le langage courant par rapport à leurs utilisations dans la construction :
- La chaux vive est le produit direct de la pyrolyse du calcaire, principalement de l'oxyde de calcium (CaO).
- La chaux aérienne, ou chaux éteinte, est obtenue par la réaction de la chaux vive avec de l'eau. Elle est constituée surtout d'hydroxyde de calcium (Ca(OH)2). Elle est dite aérienne, car elle réagit avec le CO2 de l'air.
- La chaux hydraulique est constituée en plus de silicate et d'aluminate car elle provient à l'origine de calcaire moins pur. Elle est désignée hydraulique parce qu'elle durcit en présence d'eau.
- Enfin, la chaux désigne aussi le matériau « ayant fait prise » après utilisation. Bien que ce ne soit que le liant, on parle d'un mur à la chaux, mais chimiquement la chaux en question est majoritairement redevenue du calcaire (CaCO3).
Sommaire
Histoire
Le principe qui consiste à brûler une pierre pour en extraire un composant meuble que l'on pourra reconstituer ensuite a probablement été d'abord découvert avec le gypse qui, en brûlant (à 150 °C), donne du plâtre. Ce matériau plus facile à obtenir a été découvert avant la chaux, mais des mélanges plâtre et chaux sont utilisés comme support de peinture murale en Égypte dès 2600 ans avant J.-C.
Des constructions en chaux sont ensuite apparues, jusqu'à être utilisé dans toutes les constructions romaines, des habitations aux aqueducs en passant par les thermes. C'est d'ailleurs la chaux qui a donné son nom au calcaire, qui vient du latin calcarius, « qui contient de la chaux » et calcix, la chaux.
Des nombreuses techniques d'application utilisées à l'époque romaine, ont traversé le Moyen Âge. L'utilisation de la chaux est pourtant restée quasiment incontournable dans le bâti jusqu'à la découverte du ciment au milieu du XIXe siècle. Il a rapidement remplacé la chaux dans toutes les constructions modernes en raison d'une rigidité plus importante et surtout d'un coût moindre : parpaings de ciment, béton...
La chaux connait au début du XXIe siècle un regain d'intérêt. En effet le ciment est incompatible avec la maçonnerie de bâtis anciens en moellons et pierres de taille. Le ciment étant un matériaux rigide et imperméable à l'air, il ne convient pas à une maçonnerie traditionnelle qui nécessite de la souplesse et d'être perméable à l'air. La perméabilité à l'air permet à une maçonnerie de s'assécher. L'eau qu'elle absorbe par la pluie ou des remontées capillaires, peut s'évacuer par ses joints à la chaux alors que dans le cas d'un mortier au ciment, le mur ne peut pas s'assécher et conserve l'eau qu'il absorbe ce qui peut entraîner l'apparition de salpêtre, de mousses microscopiques, d'auréoles, de taches, et de coulures. Le ciment doit être employé uniquement dans la mise en œuvre de matériaux eux-même en ciment : parpaing de ciment, carrelage...
Les différents types de chaux
La chaux vive
La chaux vive est la chaux sortie du four à chaux. Le principal constituant de la chaux vive est l'oxyde de calcium, qui a pour formule CaO.
Après apport d'eau, une réaction chimique se produit. Elle devient la chaux éteinte Ca(OH)2 (portlandite) utilisée dans le bâtiment pour la maçonnerie et la réalisation d'enduits : chaux grasse ou chaux aérienne, chaux hydraulique naturelle.
Hydratation
Mise en contact avec de l'eau, il se produit une réaction très exothermique. Cette étape est nécessaire à l'obtention de chaux éteinte, qu'elle soit aérienne ou hydraulique.
Dans le cas de la chaux hydraulique, il est nécessaire d'employer la quantité juste d'eau, afin de ne pas permettre la prise du matériau. Dans le cas de la chaux obtenue à partir de calcaire pur (chaux aérienne), la quantité d'eau n'est pas limitée.
Lorsque la quantité d'eau ajoutée est juste suffisante pour obtenir la réaction d'extinction, c’est-à-dire d'hydratation de la chaux, on obtient une poudre blanche. Si la quantité d'eau est plus importante, on obtient une pâte blanche qui peut se dissoudre à des pH plus importants.
Précautions et utilisation
La chaux vive est un produit potentiellement dangereux, principalement employé dans l'industrie et l'agriculture. Hydrophile, elle est utilisée pour assécher, détruire les matières organiques riches en eau. En cas de mélange de grandes quantités de chaux vive et d'eau, la chaleur dégagée est telle que l'eau peut se mettre à bouillir et projeter de la chaux, qui est corrosive. Il est de ce fait conseillé d'utiliser des lunettes et des gants lors de la manipulation.
Il est recommandé de verser progressivement la poudre dans l'eau et non pas l'inverse.
Il est également recommandé de brasser le mélange eau/chaux vive tout au long de sa préparation, ceci afin de limiter les risques de projection.La chaux aérienne
La chaux aérienne est obtenue à partir de calcaire très pur. On la trouve sous différentes appellations : CAEB (ancienne normalisation : chaux aérienne éteinte pour le bâtiment), remplacée par CL (Calcique Lime : « chaux éteinte »), etc. C'est de l'hydroxyde de calcium Ca(OH)2.
La chaux aérienne sert depuis l'Antiquité à réaliser des mortiers pour la construction, des enduits et des badigeons sur les murs. Elle est aussi utilisée pour protéger les arbres fruitiers, ou lutter contre la putréfaction des cadavres en cas d'épidémie.
Cycle
L'emploi de la chaux est attesté dès l'Âge du Bronze (environ 2000 ans avant J.-C.) sur certains sites archéologiques suisses. Des blocs de calcaire calcinés constituent ainsi le noyau interne des murailles de certaines places fortifiées.
Calcination
Par calcination du calcaire aux environs de 900 °C (CaCO3) on obtient de la chaux vive (Oxyde de Calcium : CaO) et un fort dégagement de dioxyde de carbone (CO2):
La réaction s'accompagne d'une perte de poids d'environ 45 %, correspondant à la perte en dioxyde de carbone selon la formulation chimique :
Extinction
La transformation de chaux vive en chaux éteinte s'effectue par ajout d'eau (H2O). Cette opération d'extinction produit l'hydroxyde de calcium Ca(OH)2, avec un fort dégagement de chaleur :
Après transformation, l'augmentation du volume est de près de 30%.
L'extinction peut être réalisée de différentes manières :
- arrosage superficiel des blocs de chaux vive, puis terminaison de la réaction à l'air ;
- immersion des blocs de chaux vive dans un grand volume d'eau puis terminaison de la réaction à l'air ;
- mélange eau-chaux dans un malaxeur avec contrôle de la réaction exothermique (dans l'industrie) ;
- immersion des blocs de chaux vive dans un grand volume d'eau puis terminaison de la réaction dans l'eau.
Dans les trois premiers cas on obtient une chaux en poudre (fleur de chaux, chaux grasse, CAEB, chaux éteinte…). Dans le dernier cas, la chaux éteinte produite prend l'apparence d'une pâte (chaux en pâte) que l'on pourra garder tant que l'on maintient en surface de l'eau limitant les échanges de dioxyde de carbone (donc de carbonatation).
La chaux en poudre correspond bien aux pratiques actuelles du bâtiment (dosage en volume, mélange à la bétonnière…).
La chaux en pâte permet l'obtention de mortiers plus "gras", moins sujets à la dessiccation rapide, des enduits ou des badigeons carbonatant plus vite et donc plus résistants. Par contre, son dosage est plus difficile, le mélange avec le sable plus délicat sauf à utiliser l'outillage adapté (malaxeur planétaire, rabot…). La meilleure carbonatation de la chaux en pâte a probablement comme origine le fait que l'extinction se faisant à l'abri de l'air, aucune carbonatation partielle anticipant la prise ne se produit. Par ailleurs, la finesse de la chaux obtenue, la présence de gels colloïdaux sont autant d'éléments qu'il faudrait étudier.
Carbonatation
La prise de la chaux aérienne s'effectue par carbonatation, c’est-à-dire en absorbant le dioxyde de carbone (CO2) présent dans l'atmosphère : d'où son nom de « chaux aérienne » :
Selon l'humidité du milieu, cette réaction se produit sur plusieurs mois : la vapeur d'eau se lie avec le dioxyde de carbone atmosphérique pour former l'acide carbonique ; la chaux fixe le dioxyde de carbone contenu dans cet acide et se transforme en calcaire. Le résultat de cette opération est à nouveau du calcaire (CaCO3).
Le mécanisme de prise par carbonatation s'effectue en présence d'eau, d'où une maîtrise indispensable des conditions de mise en œuvre (humidification des supports, contrôle des conditions climatiques...).
Utilisation
Les usages de la chaux aérienne sont nombreux. En France, son usage se répartit ainsi :
- Sidérurgie : environ 40 %,
- Travaux publics, routes : environ 13 %,
- Agriculture : environ 10 %,
- Traitement des eaux : environ 10 %,
- Construction, bâtiment : environ 3 %
- Absorption du dioxyde de carbone : appareils d'anesthésie et respiratoires de secours.
Utilisation dans l'agriculture
Pour l'agriculture, on utilise de la chaux magnésienne ou dolomitique, qui amende les sols acides en apportant du magnésium. On utilise, le plus souvent, de la chaux calcique. Les chaux utilisées par l'agriculture sont toujours sous forme d'oxyde de calcium, ou d'oxyde de calcium combiné à l'oxyde de magnésium. Cet amendement est à utiliser modérément sur les sols argileux. Le rôle de l'ion calcium dans le complexe argilo-humique est déjà tenu par le fer.
En plus d'être un amendement calcique et magnésien, le chaulage permet également la destruction des micro-organismes pathogènes contenus par les effluents d'élevage qui sont acides par nature. La base OH- associée au calcium qui arrive soudainement dans le milieu provoque une augmentation rapide du pH. Ainsi ces organismes sont détruits.
Le plus souvent, l'agriculture utilise aussi du calcaire non cuit pour amender les terrains. C'est du carbonate de calcium, vulgairement appelé "carbonate de chaux". Le mode d'action est plus lent que celui de la chaux calcinée. Cela provient du fait que l'acidité du terrain doit dégrader le produit avant que celui-ci ne devienne un oxyde et puisse développer la base associée recherchée. Il ne peut garantir une bonne efficacité agronomique que s'il est suffisamment fin pour se solubiliser correctement. L'avantage à l'utilisation de carbonate de calcium est d'ordre économique, car il coute moins cher à l'utilisateur, et écologique, car il ne détruit pas les organismes utiles du sol. Dans l'absolu, son pouvoir neutralisant est, à quantité égale, très inférieur à celui de la chaux vive.
Utilisation dans l'industrie, dans le traitement des eaux, dans le traitement des fumées
La chaux aérienne est largement utilisée dans l'industrie, le plus souvent sous forme de chaux vive, on utilise sa capacité d'agglomération de certains matériaux on parle de « floculation ».
En sidérurgie, l'ajout de chaux dans le métal en fusion permet l'extraction de certaines impuretés.
Dans le traitement des eaux usées, on stabilise les boues.
Dans les incinérateurs elle est utilisée pour neutraliser les fumées acides chargées en soufre et/ou en chlore.Utilisation dans les travaux publics
La chaux aérienne est également utilisée dans la réalisation des routes ou des chemins, le plus souvent sous forme de chaux vive. Comme dans l'industrie, on utilise sa propriété de « floculation », il s'agit ici de transformer l'argile (consistance plastique, souple, instable) en matière grumeleuse plus résistante à la compression des sols. A cette action viens s'adjoindre l'effet de consommation d'eau interstitielle. Ce faisant, la teneur en eau des sols trop humides est rabaissée afin d'atteindre le plus souvent l'Optimum Proctor. Cette propriété est également utilisée dans le monde agricole.
Utilisation comme absorbeur de dioxyde de carbone
Les propriétés d'absorption du dioxyde de carbone par la chaux ont été utilisées dans les appareils respiratoires dits "en circuit fermé" pour épurer le gaz expiré du dioxyde de carbone et permettre sa ré-inhalation après un éventuel apport d'oxygène à très faible débit. Ces techniques sont utilisées en médecine (anesthésie en circuit fermé), dans des appareils respiratoires utilisés en milieux de gaz dangereux. Les activités sous-marines (plongée et sous-marins) utilisent également la chaux comme absorbeur de dioxyde de carbone. La chaux hydratée est mélangée à d'autres composés chimiques comme la soude (NaOH) pour former la chaux sodée ou avec d'autres composés qui accélèrent la vitesse de réaction de la chaux. La présentation en grains poreux de quelques millimètres dans des récipients adaptés au passage des gaz augmente la surface d'échanges et permet l'absorption avec de faibles volumes de chaux facilement transportables.
La chaux hydraulique
La chaux hydraulique est obtenue à partir de calcaire contenant des silicates, aluminates, des composés de magnésium. La chaux hydraulique la plus courante provient de la calcination de calcaire mêlé d'argile. Elle fait prise, en quelques heures, au contact de l'eau, d'où son appellation.
Carbonatation de la chaux hydraulique
Le calcaire naturel est le plus souvent mélangés à des marnes et des argiles riches en éléments chimiques principalement la silice et aussi le fer, l'aluminium. Aux températures de cuisson (800 °C et 1 500 °C), le calcium se combine avec ces éléments pour former des silicates, des aluminates et des ferro-aluminates de calcium.
Au contact de l'eau, lors de l'extinction de la chaux vive, et surtout pendant la mise en œuvre des mortiers, ces molécules forment des hydrates insolubles. Les proportions d'alumine et de fer sont très faibles : dans les liants blancs, les teneurs en fer sont inférieures à 0,1 ou 0,2%. La prise hydraulique est essentiellement due à la réaction entre le CaO et les silicates.
C'est après la mise en œuvre que la chaux et les hydrates vont se carbonater au contact de l'air humide pour redonner le carbonate de calcium et la silice d'origine. C'est la partie aérienne de la prise.
Le rapport entre différents composants associés à l'argile et la part en chaux définit l'indice d'hydraulicité.
Conditionnement et stockage
La chaux est aujourd'hui conditionnée en sac de 25 kg. Le stockage doit être fait dans un endroit sec.
Voir aussi
Articles connexes
Liens externes
- Association européenne de la chaux (EuLA)
- (en) National Lime Association (NLA)
- (fr) Les chaux naturelles
- Portail de la chimie
- Portail du travail et des métiers
Catégories : Ciment | Hydroxyde | Composé du calcium | Oxyde
Wikimedia Foundation. 2010.