- 1344-28-1
-
Alumine
Alumine 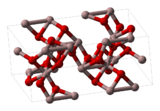
Structure cristalline du corindon Général Synonymes oxyde d'aluminium
bauxiteNo CAS No EINECS PubChem SMILES Apparence poudre blanche.[1],
cristaux hexagonauxPropriétés chimiques Formule brute Al2O3 [Isomères] Masse molaire 101,9613 g∙mol-1
Al 52,93 %, O 47,07 %,Propriétés physiques T° fusion 2 054 °C[1] T° ébullition 3 000 °C[1] Solubilité dans l'eau : nulle[1] Masse volumique 3.97 g/cm³[1] Précautions SIMDUT[2] Produit non contrôlé Écotoxicologie DL50 rats >5000 mg/kg Unités du SI & CNTP, sauf indication contraire. L’alumine ou oxyde d’aluminium, de formule chimique Al2O3, est un composé chimique qui existe à l'état naturel dans la bauxite, sous forme d'alumine hydratée mélangée avec de l'oxyde de fer.
L'alumine a été isolée en 1754 par le chimiste allemand Marggraf à partir de l'alun. C'est Louis Guyton de Morveau (1737-1816), collaborateur de Lavoisier, qui baptisa alumine l'un des sulfates contenu dans l'alun.
L'extraction de l'alumine de la bauxite est réalisée suivant un procédé chimique appelé procédé Bayer inventé par l'Autrichien Karl Josef Bayer. La bauxite y est attaquée par la soude à haute température et sous pression. La première usine à exploiter ce procédé est l'usine de Gardanne (anciennement Pechiney) en 1894. Cette usine produit toujours à ce jour des alumines hydratées et calcinées suivant ce procédé.
L'alumine est exploitée industriellement pour obtenir de l'aluminium par le procédé électrolytique Héroult-Hall. Elle est aussi utilisée comme matériau réfractaire (résistant aux très fortes températures) et comme céramique, et peut être également utilisée sous forme de corindon pour fabriquer des abrasifs.
Plusieurs pierres précieuses sont à base d'alumine anhydre, colorée ou non par des oxydes métalliques : rubis, topaze, saphir.
Sommaire
Propriétés de l'alumine
Propriété Valeur Point de fusion 2 054 °C (±6°C); (2327 K) Point d'ébullition 3 530 °C Coefficient de dilatation à 25 °C 7,1 10-6 K-1 Conductivité thermique à 25 °C 0,46 J.cm-1.s-1K-1 Chaleur spécifique à 25 °C 0,753 J.g-1.K-1 Constante diélectrique à 25 °C 10,6 résistivité à 14 °C 1019 Ω.cm De par ses propriétés physiques, l'alumine qui se forme naturellement à la surface de l'aluminium par exposition au dioxygène de l'air, forme, contrairement à la rouille dans le cas du fer, une couche hermétique protectrice qui empêche le reste de l'aluminium d'être oxydé.
Polymorphes de l'alumine
Variété Réseau cristallin Désignation chimique Formule chimique Domaine de température
de formation (°C)Densité Alumine amorphe _ Oxyde d'aluminium Al2O3 < 50-60 3,40 Bayerite Monoclinique Trihydroxyde d'aluminium (alpha) α-Al(OH)3 60-90 2,53 Boehmite Orthorhombique Trihydroxyde d'aluminium (gamma) γ-AlOOH >90 3,01 Corindon hexagonal Oxyde d'aluminium (alpha) α-Al2O3 >350 3,96 Statistiques de production
Unité : 1000 tonnes Afrique Amérique
du NordAmérique
latineAsie Europe
(avec Russie)Océanie Total 1974 655 8174 4226 2409 3961 4918 24343 1979 656 7344 4003 1877 4768 7386 26034 1984 550 5750 4604 2116 5232 8800 27052 1989 626 5942 6647 2493 5006 10823 31537 1994 648 5533 8177 2338 5975 12840 35511 1999 569 5915 10865 4050 10008 14378 45785 2003 731 6084 12477 5178 11319 16792 52581 Source
International Aluminium Institute (http://www.world-aluminium.org/iai/stats/index.asp)
Les valeurs incluent l'alumine destinée à la production d'aluminium (la proportion la plus importante) ainsi que l'alumine destinée à d'autres utilisations.Notes et références de l'article
- ↑ a , b , c , d et e OXYDE D'ALUMINIUM, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Oxyde d'aluminium (alpha-) » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
Voir aussi
Articles connexes
Liens et documents externes
- (en) handbook of porous solids volume 3 - Wiley-VCH (2002) -
- Portail des minéraux et roches
- Portail de la chimie
- Portail de la céramique
Catégories : Composé de l'aluminium | Matériau céramique | Oxyde
Wikimedia Foundation. 2010.

