- Hexafluorure de xénon
-
Hexafluorure de xénon 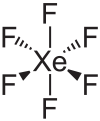
Structure de l'hexafluorure de xénonGénéral No CAS SMILES InChI Propriétés chimiques Formule brute XeF6 Masse molaire[1] 245,283 ± 0,006 g·mol-1
F 46,47 %, Xe 53,53 %,Propriétés physiques T° fusion 49,25 °C T° ébullition 75,6 °C Solubilité Réagit avec l'eau Masse volumique 3 560 kg·m-3 à 15 °C Unités du SI & CNTP, sauf indication contraire. L'hexaflurorure de xénon est le composé du xénon de formule XeF6. C'est un solide cristallin incolore stable à température ambiante, et le plus énergique des agents fluorants du xénon. On le prépare en chauffant le difluorure de xénon à 300 °C sous 6 MPa pendant suffisamment longtemps pour que la concentration d'hexafluorure devienne significative.
Propriétés chimiques
L'hexafluorure de xénon s'hydrolyse par étapes en libérant du fluorure d'hydrogène pour aboutir au final au trioxyde de xénon[2] :
L'hexafluorure de xénon se comporte comme une base de Lewis, pouvant capturer un ou deux ions fluorure :
- XeF6 + F− → XeF7−
- XeF7− + F− → XeF82−
Le sel Rb2XeF8 est l'un des composés les plus stables du xénon : il ne se décompose qu'au-delà de 400 °C[3].
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- E. H. Appelman, « Hydrolysis of Xenon Hexafluoride and the Aqueous Solution Chemistry of Xenon », dans Journal of the American Chemical Society, vol. 86, no 11, juin 1964, p. 2141–2148 [lien DOI]
- Holleman, A. F.; Wiberg, E. « Inorganic Chemistry » Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
Articles connexes
Wikimedia Foundation. 2010.
