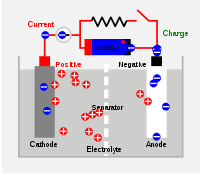
- Générateur électrochimique
-
Accumulateur électrique
Un accumulateur électrique est un dispositif destiné à stocker l'énergie électrique et à la restituer ultérieurement.
On distingue :
- Les accumulateurs d'énergie convertissant l'énergie électrique dans une autre forme afin de la stocker (par exemple en énergie cinétique) et, qui sont capables de la restituer ultérieurement. Voir : stockage d'énergie ;
- Les accumulateurs électriques fonctionnant selon les principes de l'électrostatique : bouteille de Leyde, condensateurs ;
- Les accumulateurs électriques fonctionnant selon les principes de l'électrodynamique : circuit bobiné ;
- Les accumulateurs électrochimiques, fonctionnant grâce aux réactions électrochimiques de leurs électrodes, qui assurent la conversion de l’énergie chimique en énergie électrique ;
- Les piles qui ne sont pas des accumulateurs électrochimiques, car elles ne sont pas rechargeables. Piles et accumulateurs électrochimiques sont des générateurs électrochimiques. Les piles fournissent la quantité d'électricité prévue à leur fabrication (aucune charge, ni préparation n'est nécessaire avant utilisation).
Sommaire
Généralités
L'énergie électrique peut donc se stocker de différentes manières :
- Sous forme d'énergie électrostatique, en accumulant des charges électriques dans un ou plusieurs condensateurs. L'apparition, vers 1995, de condensateurs dont la capacité peut atteindre quelques centaines de farads permet de réaliser des substituts aux batteries d'accumulateurs classiques. Les avantages sont une diminution du poids et un fonctionnement possible par très grand froid (véhicules polaires). Avec un inconvénient de taille le prix au Wh stocké nettement plus élevé.
- Sous forme d'énergie électromagnétique, en établissant un courant électrique dans un circuit bobiné autour d'un circuit magnétique, de telle sorte que l'énergie nécessaire pour mettre en mouvement les charges électriques puisse être restituée par induction. La durée de stockage de l'énergie reste faible même avec les meilleurs métaux conducteurs que sont l'argent et le cuivre en raison des pertes par effet Joule dans le circuit ; un stockage de longue durée nécessite ainsi l'utilisation de matériaux supraconducteurs. Les dispositifs ainsi réalisés sont connus sous le nom de SMES : Superconducting Magnet Energy Storage.
- Sous forme électrochimique, qui présente la caractéristique intéressante de fournir une tension (différence de potentiel) à ses bornes peu dépendante de sa charge (quantité d'énergie stockée) ou du courant débité. On utilise la propriété qu'ont certains couples chimiques d'accumuler une certaine quantité d'électricité en modifiant leur structure moléculaire et ceci de manière réversible.
- Différents types de couples chimiques sont utilisés pour la réalisation d'accumulateurs électriques.
Compte tenu des limites des techniques de stockage direct de l'électricité, le mot accumulateur désigne en électrotechnique principalement le dispositif électrochimique.
Caractéristiques générales des accumulateurs électrochimiques
Tension électrique
La tension ou potentiel (en volt) est un paramètre important. Fixée par le potentiel d'oxydo-réduction du couple redox utilisé, elle est de l'ordre de quelques volts pour un élément. Comme en pratique des tensions plus élevées, typiquement 12, 24 voire 48 V et plus sont requises, il suffit pour augmenter la tension de raccorder des éléments du même type en série au sein d'une batterie d'accumulateurs. C'est sans aucun doute l'origine du terme « batterie » comme synonyme courant d’ « accumulateur » et, en anglais, de « pile » ; toutefois certains évoquent une autre source étymologique possible : l'effet de choc d'un courant électrique, comme si l'appareil électrique « battait » celui qui reçoit la décharge.
Charge électrique
La charge électrique (une quantité d'électrons, parfois appelée à tort dans le langage courant capacité électrique) est généralement indiquée en (m)Ah ((milli)ampère(s) pendant une heure) par le constructeur. Elle se mesure dans la pratique en multipliant un courant constant par le temps de charge/décharge, en Ah (ampère-heure) ou mAh (milliampère-heure), mais l'unité officielle de charge (SI) est le coulomb équivalent à un As (ampère pendant une seconde) : 1 Ah = 1 000 mAh = 3 600 C ; 1 C = 1 Ah/3 600 = 0,278 mAh. Elle n'est comparable que pour des valeurs de tension égales. Plus significative est donc :
Énergie stockée
L'énergie stockée se mesure usuellement en Wh (wattheure) mais l'unité officielle (SI) est le Joule.
- 1 Wh = 3 600 J = 3,6 kJ ; 1 J = 0,279 mWh. Le rapport entre les deux est la tension (à supposer qu'elle soit stable) par la formule :
- 1 Wh ↔ 1 Ah × 1 V ↔ 1 A × 1 h × 1 V (valable uniquement en courant continu). En pratique inutile car la tension est variable (elle diminue proportionnellement à la charge), il faut juste retenir qu'une valeur Ah n'est pas comparable d'un voltage nominal à l'autre.
Débit maximum
Le débit maximum, ou puissance en pointe, d'un accumulateur se mesure en ampère, ou encore en watt (1 VA = 1 A × 1 V). Il est largement supérieur au débit d'utilisation courante et ne peut être maintenu sans risques.
Impédance interne
L’impédance interne, exprimée en ohm, impédance parasite qui limite le courant de décharge, ainsi que la fréquence de ce courant, en transformant en chaleur par effet Joule une partie de l'énergie restituée. En pratique, on assimile souvent l'impédance à la seule résistance pure.
Charge maximale
La charge maximale supportable est mesurée en puissance instantanée de charge, donc en ampère, mais est souvent exprimée en unité de charge, c'est-à-dire rapportée à la capacité. L'unité de charge est le rapport entre le courant de charge en A et la capacité C en Ah. Une valeur de 0,5 C correspondant à 0,5 A pour une capacité de 1 Ah ou à 1 A pour une capacité de 2 Ah, et dans les deux cas à une charge de 2 heures. Cette grandeur est également le débit maximum que peut délivrer la batterie de manière stable (souvent inférieur au débit de pointe).
Densité
La densité massique, ou énergie spécifique, est une des caractéristiques importantes d'un accumulateur, elle correspond à la quantité d'électricité (Ah/kg) ou d'énergie (Wh/kg) qu'il peut restituer par rapport à sa masse.
La densité volumique, ou densité d'énergie, est une autre caractéristique qui peut avoir son importance, elle correspond à la quantité d'électricité (Ah/m³) ou d'énergie (Wh/m³) qu'il peut restituer par rapport à son volume. On utilise plus couramment les Wh/dm³ soit Wh/l.
La densité de puissance en pointe, ou puissance spécifique correspond au débit ou à la puissance maximale rapportée à la masse de l'accumulateur, et s'exprime en ampère ou en watt par kilogramme (A/kg ou W/kg). De la même manière, on peut calculer la puissance rapportée au volume, moins usitée. Cette puissance spécifique est surtout fonction de la conductivité intrinsèque de l'accumulateur, qui doit offrir le moins de résistance possible au courant.
Vieillissement et usure
Le vieillissement et l'usure entrainent une perte progressive de la capacité des batteries avec le temps (plusieurs années) et l'usage (plusieurs milliers de cycles de charge et de décharge).
Forme physique
La forme physique est normalisée par la Commission électrotechnique internationale (CEI) et par l'American National Standards Institute (ANSI). Cependant un certain nombre d'appellations propres aux fabricants de piles subsistent.
Différentes technologies
Plomb-acide
La tension nominale d'un élément accumulateur de ce type est de 2,25 V. Il s'agit du système le plus ancien, mais aussi potentiellement l'un des plus polluants. C'est le dispositif de stockage d'énergie électrique utilisé dans la plupart des véhicules automobiles.
- L'accumulateur au plomb a été inventé par Gaston Planté qui observait l'électrolyse de l'eau acidulée.
- En essayant le plomb dans sa recherche de matières plus économiques que le platine, il remarqua que son appareil rendait de l'électricité lorsqu'on coupait l'alimentation ; comme si l'oxygène et l'hydrogène pouvaient rendre l'électricité qui les avait produits.
- Gaston Planté crut avoir inventé la pile à combustible, mais comprit vite que ce n'était pas l'oxygène et l'hydrogène gazeux qui rendaient le courant, mais la modification chimique (oxydation) de la surface du plomb.
- Son appareil se composait de deux lames de plomb maintenues écartées par des bandes isolantes. Pour augmenter la surface des électrodes, Gaston Planté enroula concentriquement deux bandes de plomb séparées par deux intercalaires de caoutchouc pour éviter tout contact entre elles, le tout contenu dans un bocal de verre rempli d’eau acidulée.
- Pour obtenir une capacité de décharge importante, Gaston Planté constata qu’il était nécessaire de faire subir aux électrodes une série de cycles charge/décharge qui constituait ce qu’il appela « la formation ».
- Le fonctionnement de la batterie ne disperse pas de plomb.
- Le plomb est un polluant, en revanche le recyclage des batteries est facile. Le transport et le recyclage des batteries est de plus en plus sévèrement réglementé, ce qui augmente les frais, diminue la rentabilité du recyclage ; par conséquent la quantité de batteries recyclées a tendance à diminuer, le prix du kilogramme de batteries devient inférieur au prix du kilogramme de ferraille.
- La durée de vie ainsi que les performances d’une batterie au plomb dépendent fortement de l’utilisation que l’on en fait. Ainsi, on a vu des batteries rendre l’âme après seulement 50 cycles alors que d’autres du même type ont tenu plus de 500 cycles. Cette forte disparité est en partie due au fait que ces batteries sont influencées par le type de cycle charge/décharge qu’on leur impose, supportent très mal les décharges profondes et nécessitent un système embarqué de contrôle très poussé afin de fournir les meilleures performances possibles.
Ni-Cd (nickel-cadmium)
La tension nominale d'un élément accumulateur de ce type est de 1,2 V. Ce couple électrochimique est l'un des plus couramment utilisés depuis plusieurs décennies pour fabriquer des batteries d'accumulateurs alimentant les appareils portatifs. Ce type d'accumulateur possède un effet mémoire, ce qui impose leur stockage dans un état déchargé (0,6 V). La fin de charge est caractérisée par une variation de la tension de charge (dv/dt) négative. C'est ce seuil qui est détecté par les chargeurs automatiques de qualité pour arrêter la charge.
Par rapport au Ni-MH, le Ni-Cd peut supporter des pointes de courant en décharge plus importantes (de l'ordre de 10 fois) mais sa décharge naturelle est beaucoup plus rapide que celle du Ni-MH. Le cadmium est très polluant. Ce type d'accumulateur permet un nombre de cycles charge/décharge plus important que les accus Li-ion et beaucoup plus important que les Ni-MH (durée de vie supérieure).[réf. nécessaire]
Notons enfin que l'augmentation considérable des cours du nickel ces dernières années a relancé le marché de ce type d'accumulateurs dans ses usages industriels (applications aéronautiques, ferroviaires, stationnaires).
Ni-MH (nickel-métal hydrure)
La tension nominale d'un élément accumulateur de ce type est de 1,2 V. Ce type d'accumulateur n'incorpore ni cadmium ni plomb et est donc peu polluant. De plus, son énergie massique est supérieure de 40 % à celle des Ni-Cd et son effet mémoire est très faible.
La fin de charge est caractérisée par une variation de la tension de charge (δv/δt) très faiblement négative. C'est ce seuil qui est détecté par les chargeurs automatiques de qualité pour arrêter la charge.
Ni-Zn (nickel-zinc)
Le NiZn est un couple connu depuis longtemps, mais qui n'avait pu être industrialisé de manière significative, à cause d'une très faible durée de vie en cyclage.
Ce problème est aujourd'hui totalement résolu par une nouvelle technologie développée en France entre 1998 et 2005.
Le NiZn constitue désormais un système à la fois d'énergie et de puissance, aux performances supérieures à celles du NiCd et du NiMH. Il accepte des régimes élevés de charge et de décharge. Sa tension nominale est de 1,65 V. Le NiZn est un accumulateur robuste, fiable et parfaitement sûr[réf. nécessaire], fonctionnant en mode sans maintenance (étanche).
Sa durée de vie en cyclage est équivalente à celle du NiCd, son autodécharge et son effet mémoire sont inférieurs.
Le NiZn est de fabrication plus économique que les autres accumulateurs alcalins (NiCd et NiMH). Il ne contient aucun métal lourd, et il est aisément et intégralement recyclable en fin de vie.
Lithium
Les accumulateurs à base de lithium sont d'une technologie récemment mise au point et en cours de développement intense, présentant un très important potentiel électrochimique.
On distingue la technologie lithium métal où l'électrode négative est composée de lithium métallique (matériau qui pose d'importants problèmes de sécurité), et la technologie lithium ion, où le lithium reste à l'état ionique grâce à l'utilisation d'un composé d'insertion aussi bien à l'électrode négative (généralement en graphite) qu'à l'électrode positive. Les problèmes de sécurité demeurent (prise de feu) en cas de surcharge, de surdécharge ou de court-circuit. Les accumulateurs lithium-ion sont partiellement remplacés par les accumulateurs lithium polymère délivrant un peu moins d'énergie, mais beaucoup plus sûrs.[réf. nécessaire]
La durée de vie de ces accumulateurs n'est que de 2 à 3 ans après fabrication, indépendamment du nombre de cycles de charges.[réf. nécessaire]
Le potentiel le plus répandu d'une cellule au lithium-ion est de 3,7 V.
Pile alcaline
Contrairement aux mentions inscrites sur leurs emballages, les piles alcalines « non rechargeables » peuvent elles aussi être régénérées partiellement. Mais seulement avec un chargeur adapté à cet usage. Les chargeurs standard (Ni-MH ou Ni-Cd) utilisent des méthodes de charges non appropriées qui rendent l'opération dangereuse, pouvant aller jusqu'à l'explosion de la pile ou du moins la destruction du conteneur avec fuite des produits acides. D'ailleurs, par sécurité et de façon générale, chaque chimie nécessite une méthode de charge spécifique donc un chargeur compatible. Pour votre sécurité, demandez l'avis d'un spécialiste.
Certes, les alcalines subiront un nombre de cycles moins grand qu'un accumulateur, même en restant dans les conditions idéales de réversibilité de la réaction chimique (en particulier, en ne déchargeant jamais les éléments à moins de 1,25 V), il est possible de les régénérer quelques dizaines de fois. En conséquence, cette possibilité est méconnue du grand public, d'autant qu'elle est réservée aux amateurs avertis des contraintes. De plus, cela ne peut être valable que pour certains usages.
Alcaline rechargeable
Il existe depuis les années 2000 une version améliorée dite alcaline rechargeable, spécifiquement destinée à être rechargée de nombreuses fois. Ce produit est manufacturé en particulier par une société canadienne[1]. Elle est disponible dans le commerce de façon presque confidentielle.
Ce type de piles alcalines est particulièrement adapté aux appareils qui ne déchargent ni trop vite, ni trop profondément leurs accumulateurs. Mais elles peuvent servir d’accu de secours grâce à la longue durée de conservation de la charge hors utilisation.
Brome
Actuellement au stade de prototype, les accumulateurs à base de brome seront probablement réservés aux installations fixes car ils nécessitent la circulation de l'électrolyte et, de plus, le brome est particulièrement dangereux.
Les couples étudiés sont : sodium-brome, vanadium-brome et zinc-brome.
Tableau comparatif des différentes technologies[2],[3]
Type Densité massique en Wh/kg Densité volumique en Wh/l Tension d'un élément Puissance en pointe (massique) en W/kg Durée de vie
(nombre de recharges)Autodécharge par mois Plomb/acide 30 - 50 75 - 120 2,25 V 700 400 - 800 5 % Ni-Cd 45 - 80 80 - 150 1,2 V ? 1 500 - 2 000 > 20 % Ni-MH 60 - 110 220 - 330 1,2 V 900 800 - 1 000 > 30 % Ni-Zn 70 - 80 120 - 140 1,65 V 1 000 > 1 000 > 20 % Na-NiCl2
(ZEBRA)120 180 2,6 V 200 800 → 100 % (12 %/jour) Pile alcaline 80 - 160 ? 1,5 - 1,65 V[4] ? 25 à 500 < 0,3 % Li-ion 90 - 180 220 - 400 3,6 V 1 500 500 - 1 000 10 % Li-Po 100 - 130 ? 3,7 V 250 200 - 300 10 % Li-PO4 (lithium phosphate) 120 - 140 190 - 220 3,2 V 800 2 000 5 % LMP (lithium metal polymer) 110 110 2,6 V 320 ? ? Li-Air 1 500 - 2 500 ? 3,4 V 200 ? ? L'accumulateur Li-Po(lymère) est moins performant que le Li-ion mais fabriqué différemment. Il prend moins de place que le Li-ion. Par conséquent une batterie Li-Po de même taille qu'une batterie Li-ion possède une capacité plus importante. Le tableau précédent donne le rapport entre l'énergie stockée (les Wh) et la masse de la batterie (en kg). Or, une batterie Li-Po est plus dense qu'une Li-ion, d'où la différence.
Voir aussi
Notes et références
- ↑ Le fabricant canadien de piles alcalines rechargeables
- ↑ Énergie - Les batteries du 3ème millénaire
- ↑ note de l'ADEME sur le stockage électrochimique
- ↑ Cette appellation regroupe des piles de technologies diverses, d'où la variabilité
Articles connexes
- Batterie d'accumulateurs
- Charge électrique
- Effet mémoire
- Pile électrique
- Stockage d'énergie
- Supercondensateur
- Portail de l’électricité et de l’électronique
- Portail de la chimie
Catégorie : Accumulateur
Wikimedia Foundation. 2010.