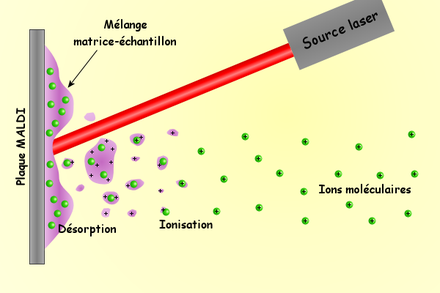
- Désorption-ionisation laser assistée par matrice
-
La désorption-ionisation laser assistée par matrice (en anglais Matrix Assisted Laser Desorption Ionisation ou MALDI) est une technique d'ionisation douce utilisée en spectrométrie de masse, permettant l'analyse de biomolécules (des biopolymères comme les protéines, les peptides et les sucres) et les grosses molécules organiques (comme les polymères, les dendrimères et autres macromolécules) qui tendent à devenir fragiles et à se fragmenter lorsqu'elles sont ionisées par des méthodes plus conventionnelles. Elle est relativement similaire à l'ionisation par électrospray en douceur relative et en ions produits (bien qu'elle crée moins d'ions multichargés).
L'ionisation est provoquée par un faisceau laser (normalement un laser à l'azote). Une matrice est utilisée afin de protéger la biomolécule de la destruction par un faisceau direct et de faciliter la vaporisation et l'ionisation.
Sommaire
Matrice
La matrice consiste en des molécules cristallisées, qui sont en général choisies parmi les trois suivantes : l’acide 3,5-diméthoxy-4-hydroxycinnamique (acide sinapique/acide sinapinique), l’acide α-cyano-4-hydroxycinnamique (alpha-cyano ou alpha-matrice) et l’acide 2,5-dihydroxybenzoïque (DHB). Une solution d'un type de ces molécules est faite, parfois dans un mélange d'eau ultra-pure et de solvant organique (habituellement de l'acétonitrile (ACN) ou de l'éthanol). L'acide trifluoroacétique (TFA) peut parfois être ajouté. Un bon exemple de solution-matrice est, par exemple, un mélange de 20 mg/ml d'acide sinapique dans l'ACN:eau:TFA (50:50:0,1).
La nature des composants pour une matrice fiable est déterminée par tâtonnement avec essais et erreurs, mais elle est basée sur des considérations spécifiques de « profils moléculaires ». Ses composants :
- sont de faible masse moléculaire (afin de faciliter la vaporisation), mais assez grosses (avec une pression de vapeur assez grande) afin de ne pas s'évaporer durant la préparation de l'échantillon ou lors de son introduction dans le spectromètre.
- sont acides, ou au moins agissant comme source de proton(s) afin de favoriser l'ionisation de l'analyte.
- ont une forte absorption dans l'ultraviolet, leur permettant d'absorber efficacement et rapidement l'irradiation laser.
- sont fonctionnalisés avec des groupes polaires, pour une utilisation en solutions aqueuses.
La solution matrice est mélangée avec l'analyte (l'échantillon). Le solvant organique permet aux molécules hydrophobes de se dissoudre dans la solution, alors que l'eau permet aux molécules hydrophiles de faire de même. La solution est ensuite déposée sur une coupelle MALDI (habituellement en métal conçue pour cet usage). Le solvant se vaporise, laissant seulement la matrice recristallisée, mais avec maintenant des molécules d'analyte réparties dans tout le cristal. La matrice et l'analyte sont dits alors co-cristallisés dans un spot MALDI.
Liste de composés utilisables comme matrice
Composé Abréviation Utilisation 9-nitroanthracène 9-NA Fullerènes Acide α-cyano-4-hydroxycinnamique HCCA Peptide (moins de 10kDa)
Hydrate de carboneAcide sinapique SA Protéine (plus de 10kDa)
Dendrimers
FullerenesAcide 2-(4-hydroxyphénylazo)benzoïque HABA Protéine (plus de 10kDa) Acide succinique - Peptide et protéine, Laser IR
Polymère synthétique, Laser IR2,6-dihydroxyacétophénone - Peptide et protéine, Laser UV Acide férulique - Peptide et protéine, Laser UV Acide caféique - Peptide et protéine, Laser UV Glycérol - Peptide et protéine, Matrice liquide 4-nitroaniline - Peptide et protéine, Matrice liquide 2,4,6-trihydroxyacétophénone THAP Oligonucléotide de moins de 3,5kDa
Hydrate de carbone acideAcide 3-hydroxypicolinique HPA Oligonucléotide de plus de 3,5kDa Acide anthranilique - Oligonucléotide de plus de 3,5kDa Acide nicotinique - Oligonucléotide de plus de 3,5kDa Acide trans-3-indoleacrylique IAA Polymère synthétique non polaire Dithranol DIT Polymère synthétique non polaire
Lipide
DendrimersAcide 2,5-dihydroxybenzoïque DHB Polymère synthétique polaire
Molécule organique
Hydrate de carboneIsovanilline - Molécule organique 3-aminoquinoline - Hydrate de carbone T-2-(3-(4-t-butyl-phényl)-2-méthyl-2-propénylidène)malononitrile DCTB Molécule inorganique 1-isoquinolinol - Oligosaccharide Acide picolinique - Oligonucléotide 2,5-dihydroxyacétophénone DHAP Protéine (plus de 10kDa) Laser
Le laser est dirigé sur les cristaux du spot MALDI. Le spot absorbe l'énergie laser et il semble que la matrice est ionisée en premier par ce fait, puis transférerait une partie de sa charge aux molécules à étudier, les ionisant tout en les protégeant d'une énergie disruptive du laser. Les ions observés après cette étape sont quasi-moléculaires, ionisés par l'addition d'un proton en [M+H]+, ou d'un autre cation comme l'ion sodium [M+Na]+, ou par la soustraction d'un proton [M-H]- par exemple. La technique MALDI produit de manière générale des ions monochargés, mais des ions multichargés ([M+nH]n+) peuvent aussi être observés, selon la matrice utilisée et/ou l'intensité du laser. Ces espèces possèdent toutes un nombre pair d'électrons. Des signaux correspondants à des cations radicalaires peuvent également être observés, par exemple dans le cas des molécules de la matrice ou d'autres molécules stables.
MALDI à pression atmosphérique
L'AP-MALDI (Atmospheric pressure matrix-assisted laser desorption/ionization) est une technique d'ionisation (source d'ions) qui contrairement à la MALDI sous vide opère dans un environnement à pression atmosphérique[1]. La différence principale entre la MALDI sous vide et l'AP MALDI est la pression sous laquelle les ions sont créés. Dans la MALDI sous vide, les ions sont produits sous 10 mTorr ou moins alors que les ions AP MALDI sont formés sous pression atmosphérique. Le désavantage de la source AP MALDI est l'observation d'une sensibilité limitée ainsi que son intervalle de masse restreint.
La technique AP MALDI est utilisée en spectrométrie de masse pour des applications variant des champs protéomiques à la découverte de nouveaux médicaments. Les sujets les plus « populaires » auxquels s'adresse la technique sont : la protéomique, ADN/ARN/ANP, lipides, oligosaccharides, phosphopeptides, bactéries, petites molécules et polymères synthétiques. Des applications similaires sont disponibles pour la technique sous vide. La source AP MALDI peut être facilement couplée à un piège à ions de spectromètre de masse[2] ou tout autre système de spectrométrie de masse équipé avec une source ESI (ionisation par électrospray) ou nanoESI.Spectrométrie de masse (MALDI-TOF)
Article détaillé : MALDI-TOF.Le type de spectrométrie de masse le plus fréquemment utilisé avec la MALDI est le TOF (spectromètre de masse à temps de vol - time-of-flight mass spectrometer), principalement en raison de sa large plage de fonctionnement en masse.
Historique
L'expression anglaise de matrix-assisted laser desorption ionization (MALDI) a été forgé en 1985 par Franz Hillenkamp, Michael Karas et leurs collègues[3]. Ces chercheurs ont découvert que l'alanine, un acide aminé, pouvait être ionisé plus facilement si elle était mélangée avec le tryptophane (autre acide aminé) et irradié avec un laser pulsé à 266 nm. Le tryptophane absorbait l'énergie laser et aidait à ioniser l'alanine non absorbante. Les polypeptides jusqu'à 2843 Da (melittine) peuvent être ionisés lorsqu'ils sont mélangés avec ce type de « matrice »[4]. L'avancée pour la désorption-ionisation laser pour une grosse molécule se produisit en 1987 lorsque Koichi Tanaka (de Shimadzu Corp.) et ses collègues utilisèrent ce qu'ils appelèrent la « méthode de la matrice métal ultra-fin/liquide » qui combinait des particules de 30 nm de cobalt dans du glycérol avec un laser à azote à 337 nm pour l'ionisation[5]. En utilisant la combinaison d'un laser et de la matrice, Tanaka était capable d'ioniser des biomolécules aussi importante que la protéine 34 472 Da carboxypeptidase-A. Tanaka reçut (conjointement) le prix Nobel de chimie 2002 pour avoir démontré qu'avec une combinaison adéquate de matrice et de laser, une protéine pouvait être ionisée[6]. Karas et Hillenkamp furent ensuite capables d'ioniser l'albumine (protéine 67 kDa) en utilisant une matrice d'acide nicotinique et un laser à 266 nm[7]. Des améliorations supplémentaires furent réalisées en utilisant un laser à 355 nm et les dérivées de l'acide cinnamique, l'acide férulique, l'acide caféique et l'acide sinapique comme matrice[8]. La disponibilité de lasers à azote fonctionnant à une longueur d'onde de 337 nm petits et relativement peu coûteux et les premiers instruments commerciaux introduits au début des années 1990 conduit de nombreux chercheurs à utiliser la technique MALDI[9]. Aujourd'hui, la spectrométrie de masse MALDI utilise principalement des matrices organiques.
Utilisation
En chimie organique
Des macromolécules synthétiques, comme les caténanes et les rotaxanes, les dendrimères, les polymères hyper-ramifiés ainsi que d'autres ensembles moléculaires, ont des masses molaires de l'ordre de milliers ou de dizaines de milliers de grammes par mole, ce qui fait que la plupart des techniques d'ionisation rencontrent des difficultés à produire des ions moléculaires. La MALDI est une méthode analytique simple et rapide qui permet aux chimistes d'analyser les résultats de ce genre de synthèses et de vérifier leurs résultats.
En biochimie
En protéomique, la MALDI est utilisée pour l'identification des protéines isolées par électrophorèse sur gel : SDS-PAGE et électrophorèse sur gel à deux dimensions. Une méthode utilisée est l'empreinte de masse de peptide par MALDI-MS, ou par affaiblissement post-ionisation ou dissociation induite par collision (voir spectrométrie de masse).
Problèmes
La préparation d'échantillon pour MALDI est importante pour le résultat. Les sels inorganiques qui sont aussi des parties des extraits de protéines interfèrent avec le processus d'ionisation. Les sels sont enlevés par une extraction en phase solide ou en lavant les spots cibles finaux à l'eau. Les deux méthodes peuvent retirer d'autres substances de l'échantillon. Le mélange de protéines de la matrice n'est pas homogène en raison de la différence de polarité qui conduit à la séparation des deux substances lors de la cristallisation. Le diamètre du spot de la cible est plus arge que celui du laser, ce qui rend nécessaire de procéder à plusieurs tirs lasers en différents endroits de la cible, afin d'obtenir la moyenne statistique de la concentration de la substance dans le spot cible. La composition de la matrice, l'ajout d'acide trifluoroacétique et d'acide formique, le délai entre les impulsions, le temps d'attente pour la puissance d'accélération, la longueur d'onde du laser, la densité d'énergie du laser et l'angle d'impact du faisceau laser figurent parmi les autres données critiques pour la qualité et la reproducibilité de la méthode.
Références
- (en) Laiko VV, Baldwin MA, Burlingame AL, « Atmospheric pressure matrix-assisted laser desorption/ionization mass spectrometry », dans Anal. Chem., vol. 72, no 4, 2000, p. 652-7 [lien PMID]
- (en) Laiko VV, Moyer SC, Cotter RJ, « Atmospheric pressure MALDI/ion trap mass spectrometry », dans Anal. Chem., vol. 72, no 21, 2000, p. 5239-43 [lien PMID]
- (en) Karas, M.; Bachmann, D.; Hillenkamp, F., « Influence of the Wavelength in High-Irradiance Ultraviolet Laser Desorption Mass Spectrometry of Organic Molecules », dans Anal. Chem., vol. 57, 1985, p. 2935-9
- (en) Karas, M.; Bachman, D.; Bahr, U.; Hillenkamp, F., « Matrix-Assisted Ultraviolet Laser Desorption of Non-Volatile Compounds », dans Int J Mass Spectrom Ion Proc, vol. 78, 1987, p. 53-68
- (en) Tanaka, K.; Waki, H.; Ido, Y.; Akita, S.; Yoshida, Y.; Yoshida, T., « Protein and Polymer Analyses up to m/z 100 000 by Laser Ionization Time-of flight Mass Spectrometry », dans Rapid Commun Mass Spectrom, vol. 2, no 20, 1988, p. 151-3
- (en)[PDF] K Markides, Gräslund, A, « Advanced information on the Nobel Prize in Chemistry 2002 »
- (en) Karas M, Hillenkamp F, « Laser desorption ionization of proteins with molecular masses exceeding 10,000 daltons », dans Anal. Chem., vol. 60, no 20, 1988, p. 2299-301 [lien PMID]
- (en) Beavis RC, Chait BT, « Matrix-assisted laser-desorption mass spectrometry using 355 nm radiation », dans Rapid Commun. Mass Spectrom., vol. 3, no 12, 1989, p. 436-9 [lien PMID]
- (en) Karas, M.; Bahr, U., « Laser Desorption Ionization Mass Spectrometry of Large Biomolecules », dans Trends Anal. Chem., vol. 9, 1990, p. 321-5
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Matrix-assisted laser desorption/ionization » (voir la liste des auteurs)
Wikimedia Foundation. 2010.