- 1,1,2-trichloro-1,2,2-trifluoroéthane
-
1,1,2-trichloro-1,2,2-trifluoroéthane 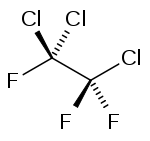
Général Nom IUPAC 1,1,2-trichloro-1,2,2-trifluoroéthane Synonymes Trichlorotrifluoroéthane
CFC-113
R-113
Fréon 113No CAS No EINECS Apparence liquide incolore, volatil, au gout et à l'odeur doux Propriétés chimiques Formule brute C2Cl3F3 [Isomères] Masse molaire[1] 187,376 ± 0,008 g·mol-1
C 12,82 %, Cl 56,76 %, F 30,42 %,Propriétés physiques T° fusion -35 °C[2] T° ébullition 48 °C[2] Solubilité 0,17 g·l à 20 °C[2] Masse volumique 1,58 g·cm-3 à 20 °C[2] T° d'auto-inflammation 680 °C[2] Point d’éclair 195 °C[2] Pression de vapeur saturante 364 mbar à 20 °C
539 mbar à 30 °C
1 094 mbar à 50 °C[2]Précautions Directive 67/548/EEC 
NPhrases R : 51/53, 59, Phrases S : 61, Transport 90 3082 Écotoxicologie Seuil de l’odorat bas : 45 ppm
haut : 70 ppm[3]Composés apparentés Isomère(s) 1,1,1-trichloro-2,2,2-trifluoroéthane Unités du SI & CNTP, sauf indication contraire. Le 1,1,2-Trichloro-1,2,2-trifluoroéthane, souvent appelé plus simplement trichlorotrifluoroéthane, ou encore CFC-113 ou R-113 est un halogénoalcane de la famille des chlorofluorocarbures (CFC) de formule Cl2FC-CClF2. Il se présente sous la forme d'un liquide incolore et très volatil.
Le CFC-113 est un chlorofluorocarbure très peu réactif, qui peut rester longtemps dans l'atmosphère s'il y est relâché. Dans la stratosphère, CF3-113 peut être scindé par ultraviolets, formant ainsi le radical Chlore. Ce radical peut réagir avec les molécules d'ozone pour former de l'oxygène moléculaire, conduisant à l'appauvrissement global de l'ozone stratosphérique. La quantité de CFC-113 reste relativement stable, d'environ 80 ppt depuis les années 1990[4]
Sommaire
Historique
CF3-113 était à l'origine utilisé en tant que liquide de refroidissement dans les climatiseurs et réfrigérateurs, en raison de son bas point d'ébullition et de sa relative inertie. CF3-113 était également utilisé comme solvant de nettoyage de composants électroniques, en particulier les téléphones. On estime qu'en 1988, 425 millions d'euros de CF3-113 avaient été utilisés, ce qui représente 17% du montant total des chlorofluorocarbones produites dans le monde[5]. Le Protocole de Montréal en 1987, a appelé à l'élimination de toutes les CFC, y compris les CFC-113 d'ici à 2010.
Structure Chimique
CFC-113 a deux isomères constitutionnels: le 1,1,1-trichlorotrifluoroéthane et le 1,1,2-trichlorofluoroéthane. Le premier isomère possède tous les atomes de chlores attaché sur un carbone, et les 3 atomes de Fluor portés par l'autre carbone. Le second isomère possède deux chlores et un fluor sur un carbone, et le second carbone porte un chlore et deux fluors. La masse molaire moléculaire de CFC-113 est 187,375 g/mol. Le temps de vie moyen du CFC-113 est estimé à 90 ans[6]. Cette longue durée de vie signifie que le CFC-113 reste longtemps dans l'atmosphère et peut participer à l'appauvrissement de l'ozone stratosphérique.
Utilisations
On peut citer des utilisations telles que:
-liquide de refroidissement dans les climatiseurs et réfrigérateur: quand le gaz est comprimé, il chauffe, quand il est détendu, il refroidit[7]. Cela le rend idéal pour les systèmes cycliques de compression de vapeur.
- combustible d'aérosol
- agent de nettoyage pour les composants électronics[8] parce qu'il ne nuit pas aux composants et du fait de sa faible toxicité et inflammabilité[9]. CFC-113 in laboratory analytics has been replaced by other solvents[10]
CFC-113 est également une molécule très volatile et apolaire, on peut donc l'utiliser comme agent moussant dans la production de matériaux d'emballage, isolation, mousses de rembourrage ou encore semelles de chaussures.
Effets sur l'environnement
Destruction de l'Ozone
CFC-113 a un effet fortement négatif sur l'environnement du fait de la scission d'ozone qu'il provoque dans la stratosphère. Il a un temps de vie assez long, d'environ 90 ans, il reste donc dans la stratosphère, où il va être rompu par radiations UV. Ils sont photodissociés par plusieurs radiations solaires de longueurs d'onde différentes dans la gamme de 190–225 nm[8]. CFC-113 peut être rompu photochimiquement selon cet exemple :
- CCl2F2 + UV (<220 nm) ⇒ Cl + CClF2
Cette réaction libère du chlore (Cl) qui est le principal destructeur de l'ozone. Ceci est néfaste pour la planète car 90 % de l'ozone de la Terre[11] se situe dans la stratosphère et peut dès lors être potentiellement dissocié par la présence de chlore, suivant ce cycle :
- Cl + O3 ⇒ ClO + 02
Cela se produit en seulement une demi-seconde et est suivi de :
- ClO + O ⇒ Cl + O2
Procédé qui ne dure que quelques minutes[9]. La fin de la réaction montre comment le chlore détruit l'ozone et est ensuite libéré, sous forme de O. Cette espèce est appelée "radical libre", signifiant qu'il peut aller et venir jusqu'à détruire un maximum de O3. Ce processus entier continue pour toute la durée de vie atmosphérique du chlore, d'environ un à deux ans. Durant cette période, il peut détruire 100 000 molécules d'ozone. Puisque l'ozone est un composé essentiel de la biosphère terrestre contre les radiations UV du soleil, c'est évidemment une dégradation majeure de la nature. La non-filtration des radiations UV par la couche d'ozone peut affecter la peau (cancer de la peau) ou la vue (jusqu'à la perte totale)[8].
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Entrée du numéro CAS « 76-13-1 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 28/05/09 (JavaScript nécessaire)
- 1,1,2-Trichloro-1,2,2-trifluoroethane sur hazmap.nlm.nih.gov. Consulté le 14 novembre 2009
- Fiche toxicologique, INRS, 2005. Consulté le 2010-12-06
- Shabecoff, Philip : New Compound Is Hailed as Boon to Ozone Shield, The New York Times (January 14, 1988). Consulté le 2008-05-28.
- Global Change 2: Climate Change, University of Michigan, January 4, 2006. Consulté le 2008-05-28
- (en) Steven Zumdahl, Chemical Principles, Lexington, D. C. Heath, 1995, 2e éd. (ISBN 978-0-669-39321-7) (LCCN 94076934)
- "Chlorofluorocarbons". Columbia Encyclopedia. 2008. Consulté le 2008-05-28 .
- HUMAN DIMENSIONS OF GLOBAL ENVIRONMENTAL CHANGE, University of Columbia. Consulté le 2010-12-06
- Use of Ozone Depleting Substances in Laboratories. TemaNord 516/2003
- Molina, Mario J. Role of chlorine in the stratospheric chemistry. Pure and Applied chemistry. 1996.
Liens externes
Catégories :- Produit chimique dangereux pour l'environnement
- Chlorofluorocarbure
- Destruction de la couche d'ozone
Wikimedia Foundation. 2010.

