- Acide orthophosphorique
-
Acide phosphorique
Acide phosphorique 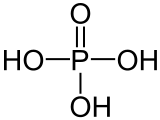
Général Nom IUPAC acide phosphorique Synonymes Acide orthophosphorique No CAS No EINECS No E E338 FEMA Apparence Solide blanc ou liquide visqueux incolore (T>42 °C) Propriétés chimiques Formule brute H3PO4 Masse molaire 97,9952 g∙mol-1
H 3,09 %, O 65,31 %, P 31,61 %,pKa 2,12, 7,21, 12,67 Propriétés physiques T° fusion 42 °C[1] T° ébullition Se décompose au-dessous du pont d'ébullition à 213 °C[1] Solubilité Miscible à l'eau
bonne dans les alcoolsMasse volumique 1.9 g/cm³[1] Pression de vapeur saturante à 20 °C : 4 Pa[1] Précautions Directive 67/548/EEC 
CPhrases R : 34, Phrases S : (1/2), 26, 45, NFPA 704 SIMDUT[2] 
SGH[3] 
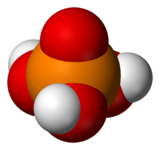
DangerInhalation Sensation de brûlure. Toux. Essoufflement. Mal de gorge. Peau Rougeur. Douleur. Brûlures cutanées. Ampoules. Yeux Douleur. Rougeur. Brûlures profondes graves. Ingestion Douleurs abdominales. Sensation de brûlure. Choc ou collapsus. Composés apparentés Autres composés Acide hypophosphoreux, Acide phosphoreux, Acide pyrophosphorique Unités du SI & CNTP, sauf indication contraire. L'acide phosphorique est un oxacide à base de phosphore de formule H3PO4. C'est un triacide. Il intervient souvent en minéralogie et a une importance capitale en biochimie.
Sommaire
Description
L'acide orthophosphorique ( o-phosphorique ) ou simplement acide phosphorique est un acide minéral obtenu par traitement du minerai de phosphate ou par combustion du phosphore.
À température ambiante, l'acide phosphorique est un solide cristallin de densité 1,83, qui fond à 42,35 °C. L'acide phosphorique est ordinairement stocké et vendu sous forme de solution finale.
Il constitue la matière première de base pour la production de phosphates (ou sels phosphatés). Sa formule chimique est H3PO4.
Chimie
Il s'agit d'un polyacide capable de céder trois protons, on l'appelle donc triacide. Il cède trois protons H + pour former les Bases : dihydrogénophosphate, hydrogénophosphate, et orthophosphate :
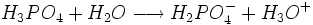
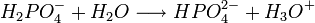
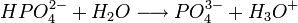
Biologie
Les dimères et trimères de l'acide phosphorique interviennent dans de nombreux domaines en biologie comme les transporteurs d'énergie ADP/ATP, l'ADN et dans les os.
Synthèse industrielle
Pour obtenir l'acide phosphorique, on traite la roche phosphate de calcium par l'acide sulfurique, puis on filtre le liquide résultant afin de retirer le sulfate de calcium dihydraté appelé " phosphogypse ". On peut également le préparer par calcination de la vapeur de phosphore, puis par traitement de l'oxyde résultant avec de la vapeur.

Utilisations
L'acide phosphorique est très utilisé en laboratoire, car il résiste à l'oxydation, à la réduction et à l'évaporation.
L'acide phosphorique est employé dans les boissons non alcoolisées comme régulateur de pH ( E338) : principalement dans les sodas au cola (Coca-Cola, Pepsi Cola)[4].
L'acide phosphorique est employé comme composant des ciments dentaires, comme catalyseur ou dans les métaux inoxydables, et dans la production des phosphates — utilisés dans les adoucisseurs d'eau, les engrais et les détergents.
L'acide phosphorique est souvent utilisé en solution dans des produits utilisés en mécanique pour dérouiller les pièces métalliques. Il sert aussi à "phosphater" les pièces pour les protéger de l'oxydantion à l'air libre.
Risques
L'ingestion d'un taux élevé d'acide phosphorique pourrait entraver le fonctionnement des reins et favoriser les calculs rénaux. Des chercheurs américains ont interrogé 465 personnes pour lesquelles une insuffisance rénale avait été récemment diagnostiquée et ont constaté à partir de la description de leur régime alimentaire qu'à partir de deux verres de coca, le risque d'insuffisance rénale est multiplié par deux. Il en est de même avec le coca "light". En revanche, aucune association n'a été trouvée avec les autres sodas, ce qui renforce la suspicion à l'encontre de l'acide phosphorique.[5]
Annexes
Notes et références
- ↑ a , b , c et d ACIDE PHOSPHORIQUE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Acide phosphorique » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ Isabelle Eustache, « Pas de coca, c'est mieux pour les reins ! » sur www.e-sante.fr, 23/07/2007. Consulté le 15 mai 2008.
- ↑ Saldana TM, Basso O, Darden R, Sandler DP., « Carbonated beverages and chronic kidney disease. » sur http://www.ncbi.nlm.nih.gov, 18/07/2007. Consulté le 16 avril 2009.
Articles connexes
Liens et documents externes
- Fiche toxicologique FT 37 - Acide phosphorique par l'Institut national de recherche et de sécurité (INRS)[pdf]
- Portail de la chimie
- Portail de la biochimie
- Portail de la biologie
Catégories : Composé du phosphore | Produit chimique corrosif | Phosphate | Oxoacide | Saveur acide | Régulateur alimentaire de pH | ADN | Séquestrant
Wikimedia Foundation. 2010.

