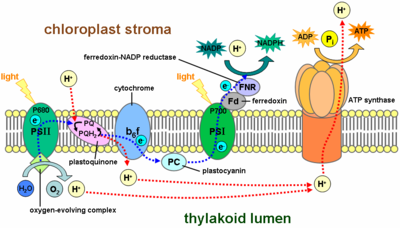
- Chaîne de transport d'électrons
-
Chaîne respiratoire
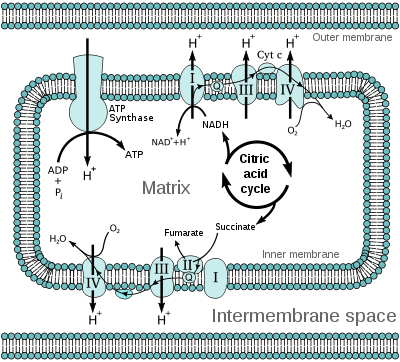 La chaîne de transport des électrons dans la mitochondrie est le lieu de la phosphorylation oxydativedans les cellules eucaryotes.
La chaîne de transport des électrons dans la mitochondrie est le lieu de la phosphorylation oxydativedans les cellules eucaryotes.
La chaîne respiratoire (aussi Phosphorylation oxydative) est constituée d'un ensemble complexe de protéines membranaires de la mitochondrie des cellules eucaryotes qui servent à réoxyder les coenzymes NADH et ubiquinone (CoQ) qui ont été réduits en particulier au cours du cycle de Krebs. Cette réoxydation s'accompagne de la création d'un gradient transmembranaire de protons. Ce gradient est une forme de stockage de l'énergie contenue dans les coenzymes, qui dérive elle-même de l'énergie contenue dans les molécules dégradées au cours du catabolisme. Le gradient de proton va servir à fabriquer de l'ATP, molécule énergétique universellement utilisable, au niveau de l'ATP synthase, une protéine membranaire mitochondriale. Ce mécanisme de phosphorylation oxydative a été découvert par Peter Mitchell, ce qui lui a valu le prix Nobel de chimie en 1978[1]. Ce mécanisme est aussi connu sous le nom de Théorie chimiosmotique (de Mitchell).
Origine des réactifs de la chaîne respiratoire
Lors des réactions du catabolisme que sont la glycolyse (dans le cytosol) et le cycle de Krebs (dans la mitochondrie) il y a production de coenzymes réduits (NADH et CoQH2). Ces coenzymes vont êtres réoxydés par la chaîne respiratoire (en aérobiose) au niveau des crêtes de la membrane interne mitochondriale ou dans la membrane plasmique des bactéries.
Enchaînement des systèmes d'oxydoréduction de la chaîne respiratoire
- Remarque
- L'enchaînement indiqué ici concerne les organismes eucaryotes, la chaîne respiratoire au niveau de la mitochondrie.
L'ordre dans lequel on trouve les éléments de la chaîne respiratoire (figure 1) dépend de leur potentiel standard d'oxydoréduction (tableau 1).
Tableau 1 : Systèmes rédox mis en jeu dans la chaîne respiratoire Systèmes rédox Potentiel standard (à pH = 7 et 25 °C) NAD+/NADH -0,32 V FP/FPH2 -0,14 V CoQ/CoQH2 -0,09 V Cytb Fe3+/Cytb Fe2+ +0,04 V CytC1 Fe3+/CytC1 Fe2+ +0,22 V CytC Fe3+/CytC Fe2+ +0,26 V Cyt(a+a3) Fe3+/Cyt(a+a3) Fe2+ +0,29 V ½O2/O2- +0,82 V 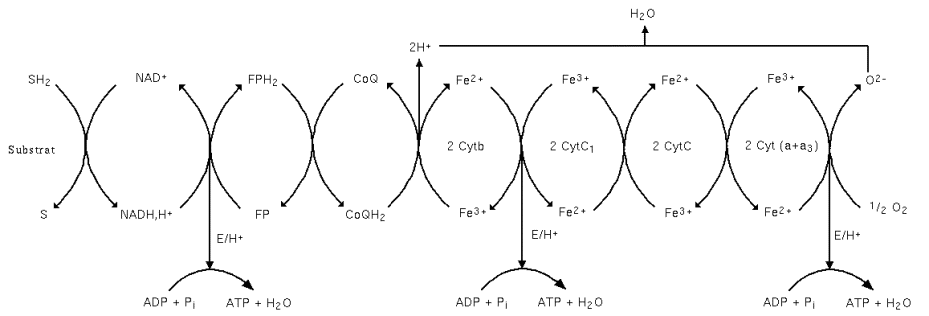
La réaction de synthèse d'ATP :
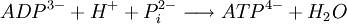
Est une réaction endergonique, elle a besoin d'énergie pour avoir lieu. Sa variation d'enthalpie libre standard (ΔG°) est égale à + 30 kJ/mol.
Lors de la chaîne respiratoire, trois réactions libèrent suffisamment d'énergie (variation d'enthalpie libre standard (ΔG°) est inférieure ou égale à - 30 kJ/mol) :
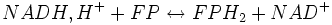 ΔG° = - 42 460 J.mol−1 ;
ΔG° = - 42 460 J.mol−1 ;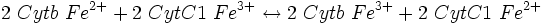 ΔG° = - 34 740 J.mol−1 ;
ΔG° = - 34 740 J.mol−1 ;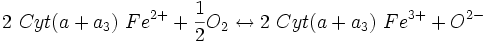 ΔG° = - 102 290 J.mol−1 ;
ΔG° = - 102 290 J.mol−1 ;
Inhibiteurs de la chaîne respiratoire
Ces inhibiteurs sont des poisons qui ont été utilisés pour identifier les intermédiaires de la chaîne respiratoire. En effet, ils ont permis d'élucider le mécanisme de fonctionnement de la chaîne respiratoire puisque leur action est très spécifique. Citons par complexe[2] :
- I - Les barbituriques, la roténone, l'amytal, la ptéricidine.
- II - Les malonates.
- III - Les antimycines A.
- IV - Le cyanure, le cobalt, les azotures, monoxyde de carbone.
- V - Le dicyclohexylcarbodiimide (DCCD), l'oligomycine, l'atractyloside.
Régulation
La régulation de la chaîne respiratoire dépend des apports en:
- NADH
- O2
- ADP+Pi
Au repos, le rapport :
![\frac {[ATP]}{[ADP+Pi]}](/pictures/frwiki/48/0b47cc09d09bc275e82324750a69a513.png) est élevé, la chaîne respiratoire tourne donc au ralenti.
est élevé, la chaîne respiratoire tourne donc au ralenti.Pendant un effort :
![\frac {[ATP]}{[ADP+Pi]}](/pictures/frwiki/48/0b47cc09d09bc275e82324750a69a513.png) diminue, on assiste donc à une augmentation de la phosphorylation oxydative (= chaîne respiratoire).
diminue, on assiste donc à une augmentation de la phosphorylation oxydative (= chaîne respiratoire).Théorie chimio-osmotique de Mitchell
Il existe 5 ensembles de protéines et de coenzymes impliqués dans les oxydations phosphorylantes de la chaîne respiratoire. Les 4 premiers complexes (I, II, III et IV) interviennent dans le transport des électrons et le cinquième (V) intervient dans la synthèse d'ATP (figure 2). Ces complexes diffusent de façon indépendante au sein de la membrane interne et connectés par un transporteur liposoluble mobile le coenzyme Q (CoQ) et le cytochrome C fixé à la membrane.
- Complexe I : NADH-ubiquinone réductase ;
- Complexe II : Succinate-ubiquinone réductase ;
- Complexe III : Ubiquinone-cytochrome C réductase ;
- Complexe IV : Cytochrome oxydase ;
- Complexe V : ATP synthase.
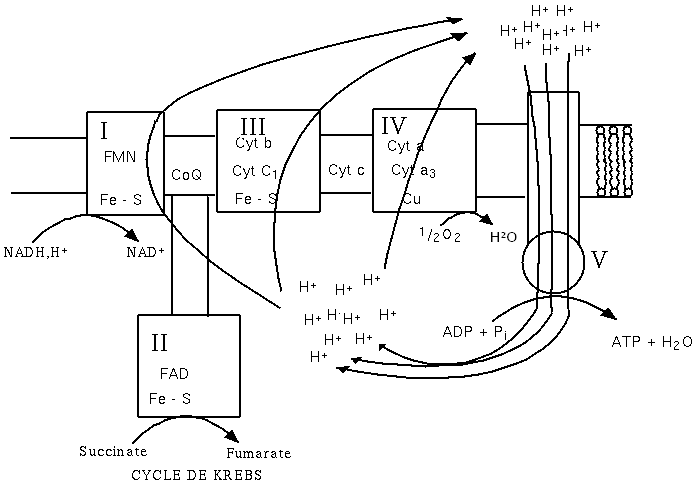
L'expulsion d'ions H+ entraîne un gradient de pH. Les ions H+ vont revenir (dans la sens du gradient électrochimique) dans la matrice mitochondriale (ou dans le cytoplasme des bactéries) en entraînant un flux d'ions dans :
- L'ATP synthase (complexe V) entraînant la synthèse d'ATP ;
- Pour le transport de molécules contre un gradient de concentration (exemple : pompe à sodium) ;
- Pour la rotation des flagelles bacteriens.
Complexes et fonctionnement
- Complexe I : Transfert d'une paire d'électron du NADH à l'ubiquinone.
- Complexe II : Livraison d'électrons de plus faible énergie provenant du succinate à l'ubiquinone :
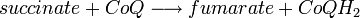 .
.
- Complexe III :
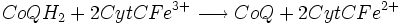
De plus, on assiste au transfert de quatre protons (H + ). On peut remarquer aussi que le cytochrome c (CytC) est très conservé dans l'évolution des espèces.
- Complexe IV :
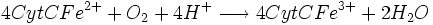
- Complexe V : Dernière étape:
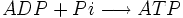 . Le flux de protons active l'ATP synthétase qui catalyse ensuite la phosphorylation de l'ADP.
. Le flux de protons active l'ATP synthétase qui catalyse ensuite la phosphorylation de l'ADP.
Les trois sous-unités β ont, à un moment donné une forme différente, en accord avec une activité fonctionnelle différente. Elles peuvent être :
- O (Open)
- L (Loose) → Faible affinité pour le substrat
- T (Tight) → Forte affinité pour le substrat
Transport des molécules d'ATP formées
Les molécules d'ATP ainsi formées se retrouvent dans la matrice mitochondriale où leur présence est peu intéressante. Pour passer dans le hyaloplasme, elles empruntent un anti-port, une protéine permettant de faire passer de l'ATP dans le sens Matrice mitochondriale (ANT1 ou 3)→ espace intermembranaire → cytosol et de l'ADP dans le sens inverse.
La différence de potentiel crée en partie par le gradient de protons induit un transport 30 fois plus rapide de l'ATP par rapport à l'ADP.
Bilan total
Il dépend du nombre de protons pompés par les complexes I, III et IV, du nombre de protons utilisés pour synthétiser 3 ATP (une rotation complète de l'ATP synthase) ainsi que de l'utilisation d'énergie proton-motrice par la mitochondrie pour importer de l'ADP et du phosphate et pour exporter de l'ATP. Pour les mitochondries de levure, on estime que:
Par NADH,H + , on produit 2,5 molécules d'ATP.
Par ubiquinone, on produit 1,5 molécules d'ATP.
Des chaînes respiratoires particulières : celles des bactéries
- La chaîne respiratoire des bactéries dites « oxydase + » (Pseudomonas, Vibrio...) est sensiblement la même que celle des mitochondries.
- La chaîne respiratoire des bactéries dites « oxydase - » (Enterobacteriaceae...) est plus courte : il n'y a pas le complexe IV de la chaîne respiratoire correspondant à la cytochrome oxydase.
- Dans certains cas (respirations anaérobies chez les bactéries), l'accepteur final de la chaîne respiratoire n'est pas du dioxygène mais un composé organique comme du CO2. Voir respiration anaérobie.
Voir aussi
Notes et références
- ↑ prix Nobel de chimie à Peter Mitchell
- ↑ GARRETT R.,GRISHAM C. Biochimie. Éditions De Boeck Université, Paris. 2000. ISBN 2744500208. Pages 698 et suivantes.
Liens externes
- Portail de la biochimie
- Portail de la biologie cellulaire et moléculaire
Catégories : Bioénergétique | Physiologie
Wikimedia Foundation. 2010.