- ATP Synthase
-
ATP synthase
 Mécanisme de l'ATP synthase. L'ATP apparait en rouge, l'ADP et le phosphate en rose et la sous unité rotative γ en noir.
Mécanisme de l'ATP synthase. L'ATP apparait en rouge, l'ADP et le phosphate en rose et la sous unité rotative γ en noir.
L'ATP synthase est un complexe protéique enzymatique qui se trouve dans les crêtes mitochondriales, la membrane des thylakoïdes, et la membrane plasmique des bactéries et des archées. Le rôle de cette protéine membranaire est de synthétiser l'ATP à partir du gradient électrochimique de protons entretenu par la chaîne respiratoire et d'Adenosine diphosphate ADP, ainsi que de Phosphate inorganique, selon la réaction suivante : ADP + Pi → ATP + H2O .
Les ATP-synthétases (ou -synthases), parfois appelées "sphères pédonculées", constituent 15% de la masse protéique de la membrane mitochondriale. Elles peuvent être considérés comme de véritables turbines (ou moteurs) moléculaires. Elles sont indispensables à la vie des organismes car l'ATP produit constitue la "monnaie énergétique" des cellules.
Sommaire
Structure
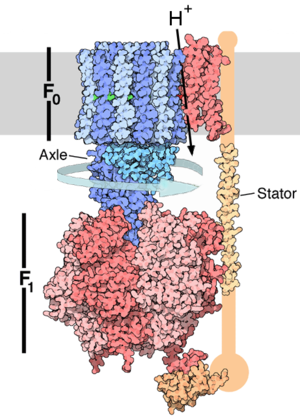
L’ATP-synthase est constituée de deux parties principales: l’une polaire et enchâssée dans la membrane apolaire, notée Fo, l’autre globulaire et au contact de la matrice mitochondriale ou du stroma (intérieur du chloroplaste), notée F1. Fo est mobile dans le plan de la membrane, et peut tourner autour d’un axe constitué par certaines des sous-unités de F1, d’où sa qualification de ROTOR. Fo comprend un nombre variable de sous-unités membranaires c (entre 10 et 15) portant des acides aminés asparagine (Asp) ayant la particularité d'être chargés négativement, ainsi que les sous-unités γ et ε. Le fait que les sous-unités c soient chargées ainsi est défavorable à la rotation de Fo. Par opposition, F1 est qualifiée de STATOR, et comprend 3 sous-unités β catalytiques responsables de la synthèse d'ATP, 3 sous unités α structurales, ainsi que les sous-unités ε, γ et δ.
La synthèse de l’ATP repose sur une conversion énergétique, via des changements de conformation des sous-unités.
Un gradient de protons de part et d’autre de la membrane dans laquelle sont insérées les ATP-synthétases est nécessaire à leur fonctionnement, ce qui implique que la synthèse d’ATP ne peut se faire indépendamment d’une membrane. Au sein de la membrane interne mitochondriale, c’est la chaîne respiratoire qui pourvoit au gradient de pH en injectant des protons dans le lumen lors du transfert des électrons d’un complexe à l’autre. Au niveau des thylakoïdes, c’est la chaîne photosynthétique qui joue ce rôle d'entretien du gradient, sorte d'"effet secondaire" de la photosynthèse.
Les protons suivent alors le gradient électrochimique (polarité de la membrane s’ajoutant à la différence de concentration) et traversent la bicouche lipidique au niveau des rotors Fo , qui constituent pratiquement les seuls points de passage. Ce flux provoque la rotation de Fo, rotation due à la neutralisation par les protons des charges portées par les asparagines, ce qui entraîne des changements de conformation des sous unités de F1. Il y a donc conversion de l’énergie osmotique de gradient électrochimique en énergie mécanique de transconformation.
Les sous-unités β en particulier connaissent trois conformations qui se succèdent : « lâche (L), serrée (S), ouvert (O) » dans cet ordre. Chacune des trois β est dans l’une de ces trois positions, qui ont un lien direct avec la fixation, la transformation et la libération des réactants de la synthèse de l’ATP. En conformation L, le site catalytique de β a une grande affinité pour l’ADP et l’orthophosphate inorganique Pi, ce qui provoque leur fixation.
En conformation S, le site actif se resserre sur les substrats et les condense en ATP, pour lequel il a une très grande affinité : l’énergie mécanique de contraction du site actif provoque la formation d’une liaison ester phosphorique entre l’ADP et le Pi. L’hydrolyse de cette liaison est très exergonique et peut être couplée à de très nombreuses réactions endergoniques au sein de la cellule. On parle de potentiel d’hydrolyse élevé. La variation d’enthalpie libre lors de la réaction d’hydrolyse de l’ATP en ADP vaut ΔG = -51,8 kJ/mole dans les conditions cellulaires. L’ATP est pour cette raison une molécule riche en énergie chimique (d’hydrolyse), mais qui ne peut en aucun cas être considérée comme une réserve énergétique (la demi-vie de l’ATP est de l’ordre de la minute). Le couple ADP/ATP peut néanmoins être assimilé à une batterie chimique, rechargée par phosphorylation de l’ADP
La conformation O, enfin, avec une détente relative du site actif , donc une moindre compatibilité tridimensionnelle avec la molécule d’ATP, permet la libération de celle-ci dans le milieu au contact avec F1 , soit le stroma ou la matrice mitochondriale.
On parle de catalyse rotationnelle. Ici, une énergie osmotique est convertie en énergie mécanique, elle-même utilisée pour recharger en énergie chimique l’ATP, qui est par ailleurs le seul organophosphate pouvant être rechargé par un tel couplage osmo-chimique, ce qui lui confère une importance de premier ordre au sein de la cellule.
Devenir de l’ATP
Au sein du chloroplaste, l’ATP libérée dans le stroma y reste jusqu’à son utilisation par les enzymes plastidiennes. Le chloroplaste ne pourvoit pas aux besoins de la cellule en matière d’ATP ! Cependant, l’ATP produite dans la matrice mitochondriale peut gagner le hyaloplasme (autrement dit : sortir de la mitochondrie), et servir au métabolisme cellulaire. Par exemple, son hydrolyse peut servir à l’établissement de gradients (voir les pompes ATP-asiques à ions), au déplacement des nanomoteurs ATP-dependants (comme la kynésine, la dynéine, la myosine…), ou plus simplement être couplée avec des réactions endergoniques très variées. L’ATP est la seule forme d’énergie chimique convertissable en énergies osmotique et mécanique, ce qui ajoute encore à son importance.
Liens externes
Une vidéo de Harvard particulièrement bien soignée sur le sujet (en anglais)
- Portail de la biologie
Catégorie : Protéine
Wikimedia Foundation. 2010.