- 629-20-9
-
Cyclooctatétraène
Cyclooctatétraène 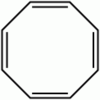
Général Nom IUPAC cycloocta-1,3,5,7-tétraène Synonymes COT, [8]annulène No CAS No EINECS PubChem SMILES InChI Apparence liquide incolore à jaune pâle (indice de réfraction = 1.537) Propriétés chimiques Formule brute C8H8 [Isomères] Masse molaire 104,1491 g∙mol-1
C 92,26 %, H 7,74 %,Propriétés physiques T° fusion −5-−3 °C[1][2] T° ébullition 142-143 °C[1] Masse volumique 0,9250 g∙cm-3, liquide à 20 °C[1] Point d’éclair 22 °C Pression de vapeur saturante 7.8 mm Hg à 25 °C[2] Précautions Directive 67/548/EEC 
T
Xi
FPhrases R : 10, 36/37/38, 45, 46, 48/23/24/25, 65, Phrases S : 26, 45, 53, 62, Transport - 2358 SIMDUT[3] 
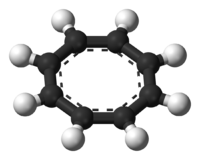
Unités du SI & CNTP, sauf indication contraire. Le cyclooctatétraène est, par abus de langage, le cycloocta-1,3,5,7-tétraène ou COT, ses autres isomères étant systématiquement numérotés. Il est un dérivé insaturé du cyclooctane avec comme formule brute C8H8. Il est aussi connu comme le [8]annulène. Cet hydrocarbure polyinsaturé est, à température ambiante, un liquide inflammable incolore à jaune clair. Comme sa formule développée est apparentée à celle du benzène, COT a été le sujet de beaucoup de recherches et de quelques controverses.Cependant, contrairement au benzène C6H6, le cyclooctatétraène C8H8 n'est pas aromatique. Sa réactivité est caractéristique d'un polyène ordinaire, i.e. il suit des réactions d'addition. En revanche, le benzène, aromatique, suit caractéristiquement des réactions de substitution, pas d'addition.
Sommaire
Histoire
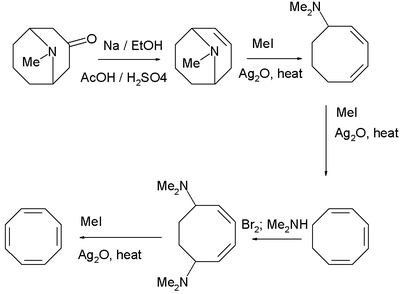
Le 1,3,5,7-cyclooctatétraène a été originellement synthétisé par Richard Willstätter à Munich en 1905[4][5].
Richard Willstätter nota que ce composé ne montrait pas l'aromaticité attendue. Entre 1939 et 1943, les chimistes américains ont essayé sans succès de synthétiser COT. Ils ont rationalisé leur manque de succès en concluant que R. Willstätter n'avait pas vraiment synthétisé ce composé mais plutôt le styrène, un isomère C8H8. R. Willstätter a répondu à ces contestations dans son autobiographie, où il a noté que les chimistes américains n'ont pas tenu compte ni été dérangés par le cyclooctane qu'il avait obtenu par réduction de son cyclooctatétraène (un produit de réaction impossible avec le styrène). En 1947, Walter Reppe à Ludwigshafen a enfin réussi à repéter la synthèse de R. Willstätter[6].
Structure et liaison
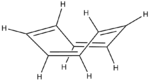
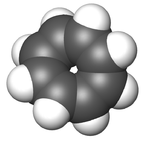
Les études[7] ont montré rapidement que COT ne suivait pas la chimie d'un composé aromatique bien que les premières expériences de diffraction électronique aient montré que les liaisons carbone-carbone étaient toutes identiques[8]. Cependant, les données de diffraction X obtenues par H.S. Kaufman démontraient que le COT contient deux distances C-C distinctes[9]. Ce résultat indiquait que le COT est un annulène avec des liaisons simples et des doubles liaisons alternées et fixes. Dans des conditions normales, le cyclooctatétraène n'est pas plan et adopte une conformation "baignoire" avec des angles C=C-C de 126.1° et C=C-H de 117.6°[10]
Synthèse et chimie
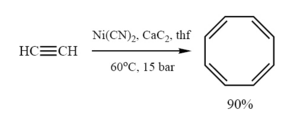
La synthèse originale de R. Willstätter qui nécessite 4 réactions d'élimination sur une structure cyclooctane, donne un rendement relativement bas. La synthèse de Walter Reppe du cyclooctatétraène qui implique de traiter de l'éthyne (acétylène) sous haute pression avec une mélange chaud de cyanure de nickel et de carbure de calcium, est bien meilleure avec un rendement proche de 90%[6].
Parce que le COT est instable et forme facilement des peroxydes organiques explosifs, une petite quantité d'hydroquinone est habituellement ajoutée au composé commercialement accessible. Il est conseillé de tester les peroxydes avant d'utiliser une bouteille déjà ouverte auparavant. Des cristaux blancs autour du col de la bouteille peuvent être composés de peroxydes qui peuvent exploser quand ils sont sollicités mécaniquement.
Les liaisons π dans le cyclooctatétraène réagissent comme d'habitude pour des oléfines et non comme celles d'un cycle aromatique. Le mono et les poly-époxydes peut être générés en faisant réagir COT avec des acides peroxydés ou avec le diméthyldioxirane. Diverses autres réactions d'addition sont aussi connues. En outre, un polyacétylène stable a été synthétisé via la polymérisation "ring-opening(en)" d'un cyclooctatétraène alkyl-substitué[11]. COT, lui-même, et aussi de dérivés avec de chaînes latérales ont été utilisés comme ligand en particuliers pour les complexes sandwich en chimie organométallique.
L'anion cyclooctatétraènure
COt réagit facilement avec le potassium métal pour former le sel K2COT, qui contient le dianion C8H82− [12]. ce dianion est à la fois plan et aromatique avec un compte d'électron de Hückel de 10.
Le cyclooctatétraène forme des complexes avec certains métaux, incluant l'yttrium et les lanthanides. Le composé sandwich EuCOT qui est uni-dimensionnel a été décrit comme des nanofils[13]. les complexes sandwich U(COT)2 ou uranocène, le même dérivé avec du thorium et Fe(COT)2 sont connus.
Occurrence naturelle
Le Cyclooctatétraène a été isolé dans certains Mycota (Fungi, champignons)[14].voir aussi
Notes
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « Cyclooctatetraene ».
- ↑ a , b et c C8H8 sur Chemical BooK
- ↑ a et b C8H8 sur ChemIDplus
- ↑ « Cyclooctatétraène-1,3,5,7 » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- ↑ The Science and Humanism of Linus Pauling (1901-1994)',Mason, S.; Chemical Society Reviews; Fev.1997, 26, 1.
- ↑ Über Cyclo-octatetraen, Richard Willstätter, Ernst Waser; Berichte der deutschen chemischen Gesellschaft, 1911, 44(3), pp 3423–3445. DOI:10.1002/cber.191104403216
- ↑ a et b Cyclisierende Polymerisation von Acetylen I Über Cyclooctatetraen; Walter Reppe, Otto Schlichting, Karl Klager, Tim Toepel; Justus Liebigs Annalen der Chemie; 1948, 560(1), pp 1–92. DOI:10.1002/jlac.19485600102
- ↑ Johnson, A.W.. Sci. Progress;1947, 506, 35.
- ↑ The ‘Octa-Benzene’, Cyclo-octatetraene (C8H8, Bastiensen O., Hassel O., Langseth A.; Nature; 1947, 160(4056), p 128. DOI:10.1038/160128a0
- ↑ Structure of Cyclo-octatetraene, Kaufman, H. S.; Fankuchen, I.; Mark, H.; Nature, 1948, 161(4083), p 165. DOI:10.1038/161165a0
- ↑ High resolution Raman spectroscopy of gases with laser sources. XIII - the pure rotational spectra of 1,3,5,7-cyclooctatetraene and 1,5-cyclooctadiene, Thomas, P. M.; Weber, A.; Journal of Raman Spectroscopy, 1978, 7(6), pp 353-357. DOI:10.1002/jrs.1250070614
- ↑ (en) Brevet U.S. 5198153
- ↑ The cyclooctatetraenyl dianion, Thomas J. Katz, J. Am. Chem. Soc.; 1960, 82(14), pp 3784-3785. DOI:10.1021/ja01499a077
- ↑ JST Nanostructed Materials Project Highlights- Prof. Nakajima's Presentation
- ↑ An endophytic Gliocladium sp. of Eucryphia cordifolia producing selective volatile antimicrobial compounds; Stinson, M.; Ezra, D.; Hess, W. M.; Sears, J.; Strobel, G.; Plant Science, 2003, 165, pp. 913-922.DOI:10.1016/S0168-9452(03)00299-1
- Portail de la chimie
Catégories : Produit chimique toxique | Produit chimique irritant | Produit chimique facilement inflammable | Cancérogène chimique | Produit chimique mutagène | Cycloalcène
Wikimedia Foundation. 2010.