- C6H11NO2
-
Vigabatrine
Vigabatrine 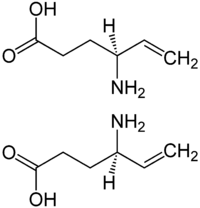
Général No CAS Code ATC N03 SMILES InChI Propriétés chimiques Formule brute C6H11NO2 [Isomères] Masse molaire 129,157 g∙mol-1
C 55,8 %, H 8,58 %, N 10,84 %, O 24,78 %,Unités du SI & CNTP, sauf indication contraire. Le vigabatrine est un anticonvulsant qui inhibe le catabolisme de GABA. Il a une structure similaire au GABA, mais n'est pas un agoniste des récepteurs.[1]
Sommaire
Mécanisme d'action
Le vigabatrine est un inhibiteur irréversible de l'acide gamma-aminobutyrique transaminase (GABA-T), l'enzyme responsable du catabolisme de GABA, ce qui augmente le niveau de GABA dans les synapses.[1]
Le vigabatrine est un composé racémique, et sont [S]-énantiomère est pharmacologiquement actif.[2],[3]
Pharmacocinétique
Dans les plupart des médicaments, la demi-vie d'élimination est un prédicteur utile des barèmes de dosage et du temps nécessaire pour atteindre un état stable. Dans le cas du Vigabatrine, par contre, il a été démontré que la demi-vie de l'activité biologique est de loin supérieur à la demi-vie d'élimination.[4]
Pour le vigabatrine, il n'y a pas de plages de concentrations cibles parce que les chercheurs n'ont trouvé aucune différence entre les niveaux de concentrations des répondeurs et non-répondeurs dans le sérum.[5] Plutôt, l'ont croit que la durée de l'action est plus une fonction du taux de resynthèse de GABA-T; les niveaux de GABA-T ne retournent habituellement pas à leurs niveaux normaux jusqu’à 6 jours après avoir arrêté la médication.[3]
Utilisations
Approuvés/Éprouvé en clinique
Canada
Au Canada, le vigabatrine est approuvé comme un traitement adjunctif (avec d'autres médicaments) dans le traitement de l'épilepsie résistante, des crises partielles complexes, des crises secondaires généralisés et pour un usage monothérapeuthique des spasmes infantiles du Syndrome de West.[1]
Mexique
Depuis 2003, le vigabatrine est approuvé au Mexique pour le traitement de l'épilepsie qui n'a pas été contrôlé de façon satisfaisante par la thérapie conventionnelle (adjonctive ou monothérapique) ou pour les patients diagnostiqués récemment qui n'ont pas encore essayé d'autres agents (monothérapie).[6]
Le vigabatrine est aussi indiqué pour un usage monothérapique pour les cas de crises partielles complexes, crises secondaires généralisés et de spasmes infantiles du Syndrome de West.[6]
Non-approuvé/En recherche
En novembre 2001, une équipe de scientifique dirigée par Peter Zwanzger de l'université de Munich a rapporté que le vigabatrine réduisait les symptômes de troubles de l'anxiété induit par la cholécystokinine tétrapeptide, en plus d'élevé les taux de cortisol et d'ACTH, chez les colontaires en santé.[7]
En 1994, Feucht et Brantner-Inthaler ont rapporté que le vigabatrine réduisait les crises de 50 à 100% dans 85% des enfants atteint du syndrome de Lennox-Gastaut qui ont eu de mauvais résultats avec un valproate.[8]
En 1984, une étude croisée en double-insu de six patients atteint de la Maladie de Huntington—cinq d'entre eux prenant des antipsychotiques—ont rapporté que le vigabatrine a fait peu, ou rien du tout, pour améliorer les mouvements hypercinétique, leur habileté à compléter les tâches quotidiennes ou normaliser les fonctions motrices.[9]
Effets secondaires
Système nerveux central
Communs
Sur 2,081 sujets, somnolence (12.5%), maux de tête (3.8%), étourdissements (3.8%), nervosité (2.7%), dépression (2.5%), troubles de la mémoire (2.3%), vision double (2.2%), agressivité (2.0%), ataxie (1.9%), vertige (1.9%), hyperactivité (1.8%), anomalies visuelles (1.6%), confusion (1.4%), insomnie (1.3%), trouble de la concentration (1.2%), troubles de la personnalité (1.1%).[1] Sur 299 enfants, 33 (11%) sont devenus hyperactifs.[1]
Rares
Quelques patients développent une psychose pendant la durée de la thérapie,[10] ce qui est plus commun chez les adultes que les enfants.[11] Même chez les patients n'ayant jamais eu d'épisode de psychose avant la thérapie.[12] D'autres effets secondaires rare sont l'anxiété, humeur labile, irritabilité, tremblements, démarche anormale et trouble de la parole.[1]
Gastro-intestinale
Communs
Douleur abdominale (1.6%), constipation (1.4%), vomissements (1.4%) et nausées (1.4%).[1]
Rares
Dyspepsie et augmentation de l'appétit chez moins de 1% des sujets de tests en clinique.[1]
Le corps
Commun
Fatigue (9.2%), gain de poids (5.0%), asthénie (1.1%).[1]
Tératogénicité
Une étude tératologique conduite sur des lapins à découvert qu'une dose de 150 mg/kg/jour était la cause d'une fissure palatine chez 2% des petits et une dose de 200 mg/kg/jour l'amenait chez 9%.[1] Ceci pourrait provenir d'une baisse du niveau de méthionine, selon une étude publiée en mars 2001.[13] En 2005, une étude réalisée Université de Catania a été publiée et mentionne que les rats dont la mère a consommé de 250-1 000 mg/kg/jour avaient une performance plus faible dans le labyrinthe d'eau et les taches en terrain ouvert, ceux du groupe de 750 mg étaient de faible poids à la naissance et n'ont pas rattrapé le groupe de contrôle et ceux du groupe de 1 000 mg n'ont pas survécu à la grossesse.[14]
Il n'y a pas eu de contrôle tératologique sur l'humain à ce jour.
À propos des anomalies visuelles
En 2003, il a été démontré par Frisén et Malmgren que le vigabatrine causait une atrophie diffuse irréversible de la fibre nerveuse rétinienne dans une étude rétrospective de 25 patients.[15] Cette effet est plus prononcé sur la partie externe (à l'opposé de la macula, ou partie centrale) de la rétine.[16]
Interaction médicamenteuses
Une étude publiée en 2002 à découvert que le vigabatrine cause une augmentation statistiquement significative de l'épuration dans le plasma du carbamazépine.[17]
En 1984, les Drs Rimmer et Richens de l'Université de Wales ont rapporté qu'administrer le vigabatrine avec la phénytoïne abaisse la concentration de phénytoïne chez les patients avec une épilepsie résistante aux traitements.[18] La concentration de phénytoïne a baissé de 23% en cinq semaines, selon une étude publiée en 1989 par les mêmes deux chercheurs qui ont essayé, et n'ont pas réussi, à identifier le mécanisme derrière cette interaction.[19]
Marque de commerce
Vigabatrine est vendu sous le nom de Sabril® au Canada,[20] Mexique[6] et au Royaume-Uni.[21]
Références et notes
- ↑ a , b , c , d , e , f , g , h , i et j Long, Phillip W. "Vigabatrin." Internet Mental Health. 1995-2003.
- ↑ G. Sheean, « Vigabatrin--plasma enantiomer concentrations and clinical effects », dans Clinical and Experimental Neurology, vol. 29, 1992, p. 107-16
- ↑ a et b Gram L, Larsson OM, Johnsen A, Schousboe A, « Experimental studies of the influence of vigabatrin on the GABA system », dans British Journal of Clinical Pharmacology, vol. 27, no Suppl 1, 1989, p. 13S-17S
- ↑ Browne TR, « Pharmacokinetics of antiepileptic drugs », dans Neurology, vol. 51, no 5 suppl 4, 1998, p. S2-7 [texte intégral]
- ↑ Lindberger M, Luhr O, Johannessen SI, Larsson S, Tomson T, « Serum concentrations and effects of gabapentin and vigabatrin: observations from a dose titration study », dans Therapeutic Drug Monitoring, vol. 25, no 4, 2003, p. 457-62 [texte intégral]
- ↑ a , b et c DEF MEXICO: SABRIL Diccionario de Especialdades Farmaceuticas. Edicion 49, 2003.
- ↑ Zwanzger P, Baghai TC, Schuele C, Strohle A, Padberg F, Kathmann N, Schwarz M, Moller HJ, Rupprecht R, « Vigabatrin decreases cholecystokinin-tetrapeptide (CCK-4) induced panic in healthy volunteers », dans Neuropsychopharmacology, vol. 25, no 5, 2001, p. 699-703 [texte intégral]
- ↑ Feucht M, Brantner-Inthaler S, « Gamma-vinyl-GABA (vigabatrin) in the therapy of Lennox-Gastaut syndrome: an open study », dans Epilepsia, vol. 35, no 5, 1994, p. 993-8 [[pdf] texte intégral (page consultée le 2006-05-25)]
- ↑ Scigliano G, Giovannini P, Girotti F, Grassi MP, Caraceni T, Schechter PJ, « Gamma-vinyl GABA treatment of Huntington's disease », dans Neurology, vol. 34, no 1, 1984, p. 94-6 [texte intégral]
- ↑ Sander JW, Hart YM, « Vigabatrin and behaviour disturbance », dans Lancet, vol. 335, no 8680, 1990, p. 57
- ↑ Chiaretti A, Castorina M, Tortorolo L, Piastra M, Polidori G, « [Acute psychosis and vigabatrin in childhood] », dans La Pediatria Medica e Chirurgica : Medical and surgical pediatrics, vol. 16, no 5, 1994, p. 489-90 [Article in Italian] PMID 7885961
- ↑ Sander JW, Hart YM, Trimble MR, Shorvon SD, « Vigabatrin and psychosis », dans Journal of Neurology, Neurosurgery, and Psychiatry, vol. 54, no 5, 1991, p. 435-9
- ↑ Abdulrazzaq YM, Padmanabhan R, Bastaki SM, Ibrahim A, Bener A, « Placental transfer of vigabatrin (gamma-vinyl GABA) and its effect on concentration of amino acids in the embryo of TO mice », dans Teratology, vol. 63, no 3, 2001, p. 127-33 [texte intégral]
- ↑ Lombardo SA, Leanza G, Meli C, Lombardo ME, Mazzone L, Vincenti I, Cioni M, « Maternal exposure to the antiepileptic drug vigabatrin affects postnatal development in the rat », dans Neurological Sciences, vol. 26, no 2, 2005, p. 89-94 [texte intégral]
- ↑ Frisén L, Malmgren K, « Characterization of vigabatrin-associated optic atrophy », dans Acta Ophthalmologica Scandinavica, vol. 81, no 5, 2003, p. 466-73 [texte intégral]
- ↑ Buncic JR, Westall CA, Panton CM, Munn JR, MacKeen LD, Logan WJ, « Characteristic retinal atrophy with secondary "inverse" optic atrophy identifies vigabatrin toxicity in children », dans Ophthalmology, vol. 111, no 10, 2004, p. 1935-42 [texte intégral]
- ↑ Agustín Sanchez-Alcaraz, « Effect of vigabatrin on the pharmacokinetics of carbamazepine », dans Journal of Clinical Pharmacology and Therapeutics, vol. 27, no 6, 2002, p. 427-30 [texte intégral]
- ↑ Rimmer EM, Richens A, « Double-blind study of gamma-vinyl GABA in patients with refractory epilepsy », dans Lancet, vol. 1, no 8370, 1984, p. 189-90
- ↑ Rimmer EM, Richens A, « Interaction between vigabatrin and phenytoin », dans British Journal of Clinical Pharmacology, vol. 27, no Suppl 1, 1989, p. 27S-33S
- ↑ drugs.com Vigabatrin Drug Information
- ↑ Treatments for Epilepsy - Vigabatrin Norfolk and Waveney Mental Health Partnership NHS Trust
Modèle:Anticonvulsants
- Portail de la pharmacie
Catégorie : Antiépileptique
Wikimedia Foundation. 2010.
