- C10H10Fe
-
Ferrocène
Ferrocène 
Représentations du Ferrocène Général Nom IUPAC ferrocene,
bis(η5-cyclopentadienyl) ferSynonymes Dicyclopentadiényle de fer No CAS No EINECS SMILES InChI Apparence cristaux orange, d'odeur caractéristique.[1] Propriétés chimiques Formule brute C10H10Fe [Isomères] Masse molaire 186,031 g∙mol-1
C 64,56 %, H 5,42 %, Fe 30,02 %,Propriétés physiques T° fusion 173 °C[1] T° ébullition 249 °C[1]
Point de sublimation : au-dessus 100 °C[1]Solubilité dans l'eau : nulle[1],
soluble dans la plupart des solvants organiquesMasse volumique 2,69 g/cm3 (20 °C) Pression de vapeur saturante à 40 °C : 4 Pa[1] Précautions Transport 40 1325 [2]SIMDUT[3] Produit non contrôlé Unités du SI & CNTP, sauf indication contraire. Le Ferrocène est un composé organométallique de formule Fe(C5H5)2. Il fait partie de la famille des métallocènes, un type de composé organométallique composé de deux cycles pentadiènyle entourant un centre métallique. Ils sont aussi appelés composés sandwich (anglais sandwich compounds)[4].
Sommaire
Historique
Comme pour beaucoup de produits, la première synthèse du ferrocène fut accidentelle. En 1951, Pauson et Kealy, de l'université de Duquesnes firent état de la réaction du bromure de magnésium de cyclopentadiènyle et du chlorure de fer dans l'objectif de coupler le diène et ainsi synthétiser le fulvalène. A la place, ils obtinrent une poudre légèrement orangée, d'une "remarquable stabilité"[5]. Cette stabilité fut accordée au caractère aromatique du cyclopentadiènyle mais la structure "en sandwich" ne fut pas découverte à cet instant.
Ce sont Robert Burns Woodward et Geoffrey Wilkinson qui découvrirent cette assemblage particulier en se basant sur sa réactivité[6]. Indépendamment, Ernst Otto Fischer arriva à la même conclusion et commença à synthétiser d'autres métallocènes, comme le nickelocène et le cobaltocène[7]. La structure des ferrocènes fut ensuite confirmée par spectroscopie RMN et cristallographie Rayons X[8],[9]. Sa structure distinctive mena à un engouement sans précédent pour la chimie des métaux du bloc d avec les hydrocarbures. En 1973 Fischer du Ludwig-Maximilians-Universität München et Wilkinson de l'Imperial College London partagèrent un Prix Nobel de chimie pour leurs travaux sur les métallocènes et autres aspects sur la chimie organométallique.
Les ferrocènes sont facilement obtenus par réaction du cyclopentadiènyle de sodium sur le chlorure de fer anhydre, en milieu éthéré.
- 2 NaC5H5 + FeCl2 → Fe(C5H5)2 + 2 NaCl
Liaisons et structure
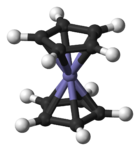
L'atome de fer dans le ferrocène est à l'état d'oxydation +2. Chaque cycle pentadiènyle est donc chargé une fois négativement, amenant le nombre d'électrons π à six sur chaque cycles. Ils sont donc aromatiques. Ces douze électrons - six pour chaque cyle - forment des liaisons covalentes avec le métal. Ajoutés aux six électrons de la couche d du fer, le complexe complait à la règle des 18 électrons. La distance des laisons carbone-carbone des cycles est de 1,40 Å. Les liaions Fer - carbone font 2,04 Å.
Propriétés physiques
Le ferrocène est un solide stable à l'air, bien qu'il se sublime assez facilement. Comme on pouvait le prévoir pour une molécule symétrique et neutre, le ferrocène est soluble dans les solvants organiques courants, mais insoluble dans l'eau. Il est stable à haute température, jusqu'à 400 °C.[10]
Le tableau suivant donne quelques valeurs de pression de vapeur à différentes températures.
Pression (Pa) 1 10 100 Température (K) 298 323 353 Propriétés Chimiques
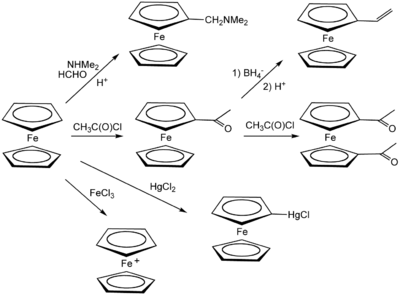
Réaction avec les électrophiles
Le ferrocène se comporte comme la plupart des aromatiques, permettant la synthèse de dérivés substitués. Une expérience classique de démonstration est une réaction de Friedel-Crafts avec l'anhydride acétique en présence d'acide phosphorique comme catalyseur. En présence de chlorure d'aluminium, Me2NPCl2 et le ferrocène réagissent pour donner la ferrocenyl dichlorophosphine[11], alors que le traitement avec la phenyldichlorophosphine dans les mêmes conditions conduit à la P,P-diferrocenyl-P-phenyl phosphine[12].
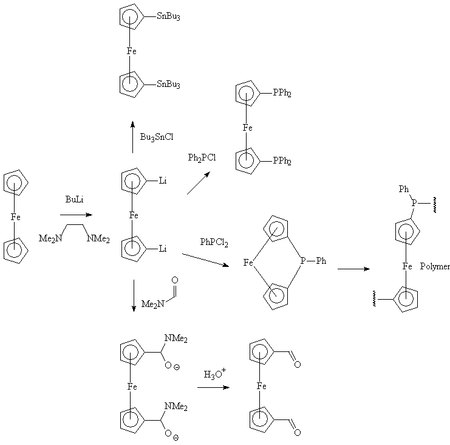
Lithiation
Le ferrocène réagit facilement avec le butyl lithium pour donner le 1,1'-dilithioferrocene, qui est un nucléophile polyvalent. Il peut réagir avec le diethyldithiocarbamate de sélénium pour donner un ferrocenophane dans lequel les deux cycles pentadiènyles sont liés par l'atome de sélénium.[13] Ce ferrocephane peut être converti en un polymère par une réaction de polymérisation par ouverture de cycle et former des poly(ferrocenyl sélénide). De même, en mettant en jeu des ferrocenophanes liés par un atome de silicium ou de phosphore, on peut obtenir les polymères correspondants (poly(ferrocenylsilane)s et poly(ferrocenylphosphines)s).[14],[15]
Oxydoréduction
Contrairement à la majorité des hydrocarbures, le ferrocène peut être oxydé une fois à faible potentiel, environ 0,5V par une électrode au calomel. L'oxydation du ferrocène donne un ion stable appelé ferrocénium. A l'échelle préparative, l'oxydation peut se faire par ajout de FeCl3 pour donner un ion bleu, [Fe(C5H5)2]+. A défaut, le nitrate d'argent peut aussi être utilisé comme oxydant.
Les sels de ferrocenium sont parfois utilisés comme oxydants, principalement pour l'inertie de ferrocène, et sa facilité à être séparé de produits ioniques..[16] L'ajout de substituants sur les cycles pentadiènyles altère le potentiel redox : les groupements attracteurs d'électrons comme les acide carboxyliques déplace le potentiel vers l'anode (donc le rend plus positif), alors que les groupements donneurs comme le méthyle le rend plus négatif. Ainsi, la décaméthylferrocène est beaucoup plus facile à oxyder que le ferrocène. Ce dernier est souvent utilisé comme étalon interne pour calibrer les potentiels rédox en électrochimie des milieux non-aqueux.
References
- ↑ a , b , c , d , e et f FERROCENE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 20090123.html FIBRES CERAMIQUES&], fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ Entrée du numéro CAS « 102-54-5 » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 27 novembre 2008 (JavaScript nécessaire)
- ↑ « Dicyclopentadiényle de fer » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- ↑ R. Dagani, « Fifty Years of Ferrocene Chemistry », dans Chemical and Engineering News, vol. 79, no 49, 3 December 2001, p. 37–38 [Modèle:Subscription required texte intégral]
- ↑ T. J. Kealy, P. L. Pauson, « A New Type of Organo-Iron Compound », dans Nature, vol. 168, 1951, p. 1039 [lien DOI]
- ↑ G. Wilkinson, M. Rosenblum, M. C. Whiting, R. B. Woodward, « The Structure of Iron Bis-Cyclopentadienyl », dans Journal of the American Chemical Society, vol. 74, 1952, p. 2125–2126 [lien DOI]
- ↑ E. O. Fischer, W. Pfab, « Zur Kristallstruktur der Di-Cyclopentadienyl-Verbindungen des zweiwertigen Eisens, Kobalts und Nickels », dans Z. Naturforsch. B, vol. 7, 1952, p. 377–379
- ↑ J. Dunitz, L. Orgel, A. Rich, « The crystal structure of ferrocene », dans Acta Crystallographica, vol. 9, 1956, p. 373–5 [lien DOI]
- ↑ Pierre Laszlo, Roald Hoffmann,, « Ferrocene: Ironclad History or Rashomon Tale? », dans Angewandte Chemie International Edition, vol. 39, 2000, p. 123–124 [lien DOI]
- ↑ Solomons, Graham, and Craig Fryhle. Organic Chemistry. 9th ed. USA: John Wiley & Sons, Inc., 2006.
- ↑ G.R. Knox, P.L. Pauson and D. Willison, « Ferrocene derivatives. 27. Ferrocenyldimethylphosphine », dans Organometallics, vol. 11, no 8, 1992, p. 2930 – 2933 [lien DOI]
- ↑ G.P. Sollott, H.E. Mertwoy, S. Portnoy and J.L. Snead, « Unsymmetrical Tertiary Phosphines of Ferrocene by Friedel-Crafts Reactions. I. Ferrocenylphenylphosphines », dans J. Org. Chem., vol. 28, 1963, p. 1090 – 1092 [lien DOI]
- ↑ Ron Rulkens, Derek P. Gates, David Balaishis, John K. Pudelski, Douglas F. McIntosh, Alan J. Lough, and Ian Manners, J. Am. Chem. Soc., 1997, 119, 10976
- ↑ Paloma Gómez-Elipe, Rui Resendes, Peter M. Macdonald, and Ian Manners, J. Am. Chem. Soc., 1998, 120, 8348
- ↑ Timothy J. Peckham, Jason A. Massey, Charles H. Honeyman, and Ian Manners, Macromolecules, 1999, 32, 2830
- ↑ N. G. Connelly, W. E. Geiger, « Chemical Redox Agents for Organometallic Chemistry », dans Chemical Reviews, vol. 96, 1996, p. 877–910 [lien DOI]
Voir aussi
- Portail de la chimie
Catégories : Composé du fer | Composé organométallique
Wikimedia Foundation. 2010.