- Bromure d'argent
-
Bromure d'argent 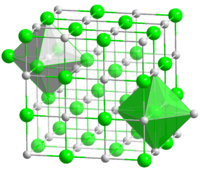
Structure cristalline de AgBr et échantillon Général Nom IUPAC Bromure d'argent No CAS Apparence solide jaune pâle Propriétés chimiques Formule brute AgBr [Isomères] Masse molaire[2] 187,772 ± 0,001 g·mol-1
Ag 57,45 %, Br 42,55 %,Potentiel de réduction 0,07133 V Moment dipolaire 5,62 ± 0,03 D [1] Propriétés physiques T° fusion 432 °C T° ébullition >1 502 °C décomposition Solubilité 14 µg/100 ml (eau, 20 °C) Masse volumique 6,473 g·cm-3, solide Thermochimie ΔfH0solide -99,5 kJ/mol ΔvapH° 198 kJ·mol-1 (1 atm, 1 502 °C)[3] Cp 0,27 J/g/°C Propriétés électroniques Bande interdite 2,5 eV Mobilité électronique 4 000 cm2·Vs-1 Constante diélectrique 12.5 Cristallographie Structure type NaCl[4] Propriétés optiques Indice de réfraction 2,253 Précautions SIMDUT[5] Produit non contrôlé Unités du SI & CNTP, sauf indication contraire. Le bromure d’argent (AgBr) est un sel insoluble de couleur jaune pâle, bien connu pour sa sensibilité inhabituelle à la lumière comme les autres halogénures d’argent. Cette propriété a permis aux halogénures d’argent de devenir le matériau de base de la photographie moderne[6]. Le bromure d’argent est largement utilisé pour les films photographiques noir et blanc. Certaines personnes avancent l’hypothèse que le suaire de Turin a été fabriqué à l’aide de bromure d’argent. À cause de ses propriétés de photosensibilité, le bromure d’argent est aussi considéré comme un semi-conducteur[7]. Ce sel peut être trouvé naturellement dans le minéral bromargyrite (bromyrite).
Sommaire
Préparation
Bien que ce composé puisse être extrait d’un minéral disponible dans la nature, AgBr est typiquement préparé par la réaction du nitrate d’argent avec un bromure alcalin, le plus souvent le bromure de potassium[6] :
Bien que moins pratique, ce sel peut aussi être préparé directement à partir de ses éléments constitutifs (Ag et Br).
La préparation moderne d’une surface sensible à la lumière se fait en formant une émulsion de cristaux d’halogénures d’argent dans de la gélatine, avec laquelle on enduit un film ou autre support. Les cristaux sont formés par précipitation dans un environnement contrôlé afin de produire de petits cristaux uniformes (typiquement inférieurs à 1 μm de diamètre et contenant ~1012 atomes d’Ag) appelés grains[6]. Plus les grains sont fins, meilleure sera la résolution du film photosensible.
Réactions
Le bromure d’argent réagit rapidement avec de l’ammoniac pour former plusieurs complexes aminés[8].
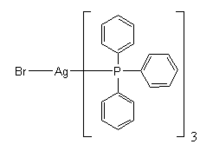
Le bromure d’argent réagit avec de la triphenylphosphine pour donner un tris-(triphenylphosphine)[9]. Ce composé permet d’avoir une photo noir et blanc plus nette.
Propriétés physiques
Structure cristalline
AgF, AgCl et AgBr ont tous une structure de réseau de type cubique à faces centrées (CFC) (comme le NaCl). Les paramètres de réseau sont les suivants[10] :
Propriétés des réseaux d'halogénures d'argent Composé Cristal Structure Réseau, a /Å AgF cfc NaCl 4,936 AgCl, Chlorargyrite cfc NaCl 5,5491 AgBr, Bromargyrite cfc NaCl 5,7745 Structure de la maille 
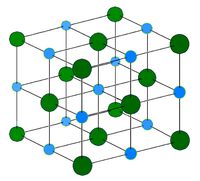
cubique face centrée Structure de type NaCl
Les ions halogénures forment un empilement compact cubique, tandis que les ions d’argent, plus petits, remplissent les sites octaédriques situés entre les halogénures, donnant ainsi une structure où un ion Ag+ est entouré de 6 ions bromure Br– et vice-versa. La structure du AgBr (type cubique NaCl) est inattendue pour l’argent monovalent (Ag(I)) qui forme d’ordinaire des complexes linéaires, trigonaux ou tétragonaux. Contrairement aux autres halogénures d’argent, l’iodargyrite (AgI) présente une structure hexagonale.Solubilité
Les halogénures d’argent ont une large gamme de solubilité, il faut noter que la solubilité du AgF est d’environ 6×107 fois plus grande que celle de AgI. Ces différences sont attribuées aux enthalpies relatives de solvatation des ions halogénures ; l’enthalpie de solvatation du fluorure est anormalement grande[11].
Solubilité des halogénures d'argent Composé Solubilité (g / 100 g H2O) AgF 172 AgCl 0,00019 AgBr 0,000014 AgI 0,000003 Photosensibilité
Bien que les propriétés photographiques aient été exploitées depuis le milieu du 19e siècle, il n’y avait pas d’explication théorique valable jusqu’en 1938 avec la publication de l’article de R.W. Gurney et N.F. Mott[12]. Cet article rassemblait de nombreuses recherches dans les domaines de la chimie et de la physique de l’état solide, et plus particulièrement dans les phénomènes de photosensibilité des halogénures d’argent[6]. En outre, des recherches plus approfondies ont révélé que les propriétés photographiques des halogénures d’argent (en particulier AgBr) sont le résultat de déviations par rapport à la situation cristalline idéale. Des facteurs comme la taille du cristal, des impuretés et des défauts de surface contribuent tous à modifier les concentrations en défauts ioniques et déficiences électroniques, qui par conséquent affectent la sensibilité à la lumière et permettent la formation d’une image latente (l'image est « imprimée » sur le film mais ne sera visible qu'après développement)[7].
- Défauts Frenkel et déformation quadripolaire
Le défaut majeur des halogénures d’argent est le défaut de type Frenkel, où certains ions d’argent quittent leur position « d’équilibre » et se placent interstitiellement (Agi+) en haute concentration avec création de lacunes en ions argent (charge négative) (Agv-) à la position d’origine de l’ion. Ce qui est unique pour les défauts de Frenkel dans le bromure d’argent, c’est que l’ion argent interstitiel Agi+ est exceptionnellement mobile et que la concentration en défauts dans la couche près de la surface du grain est très grande par rapport à celle au centre du grain[7],[13].
L’énergie de formation de la paire Frenkel est inférieure à 1,16 eV et l’énergie d’activation de migration est inhabituellement inférieure à 0,02 eV (en comparaison au NaCl : 2,18 eV pour la formation d’une paire Schottky et 0,75 eV pour la migration cationique). Ces faibles énergies favorisent de grandes concentrations en défauts, lesquelles peuvent atteindre près d’1 % à une température proche du point de fusion[13]. La cause de cette faible énergie d’activation dans le bromure d’argent peut être attribuée à la haute polarisabilité quadripolaire des ions argent, qui peuvent se déformer d’une sphère en ellipse. Cette propriété, découlant du résultat de la configuration électronique de l’ion argent (d9), facilite la migration aussi bien des ions argent que des lacunes, donnant ainsi une énergie de migration inhabituellement basse (pour Agv– : 0,29–0,33 eV, comparée à 0,65 eV pour le NaCl)[13].
Des études ont démontré que les concentrations en défaut sont fortement affectées (jusqu’à plusieurs puissances de dix) par la taille du cristal. La plupart des défauts, comme la concentration en ions argent interstitiels, sont inversement proportionnels à la taille du cristal, alors que les défauts de lacunes sont directement proportionnels. Ce phénomène est attribué aux changements dans l’équilibre chimique des surfaces et affecte chaque concentration en défaut différemment[7]. Les concentrations en impuretés peuvent être contrôlées par la croissance cristalline ou par l’addition directe d’impuretés aux solutions cristallines. Bien que les impuretés dans le réseau du bromure d’argent soient nécessaires pour favoriser la formation des défauts Frenkel, des études publiées par Hamilton ont montré qu’après une concentration donnée en impuretés, le nombre de défauts en ions argent interstitiels diminue fortement de plusieurs puissances de dix. Après cette concentration, seuls les défauts de lacunes des ions argent, qui augmentent de plusieurs ordres de magnitude, sont prédominants[7].
- Les déficiences électroniques et les déficiences en trou
Quand de la lumière tombe sur la surface d’un grain d’halogénure d’argent, un photoélectron est généré quand un halogénure perd un électron de la bande de valence vers la bande de conduction[6],[7],[14].
Quand un électron est relâché, il se combine avec un Agi+ interstitiel pour créer un atome de d’argent métallique Agi0 [6],[7],[14]:
À travers les défauts dans le cristal, l’électron est capable de réduire son énergie et d’être capturé par l’atome[6]. L’étendue des joints de grains et les défauts dans le cristal affectent la durée de vie du photoélectron. Les cristaux avec une grande concentration en défauts capturent plus vite un électron qu’un cristal pur[14].
Quand un photoélectron est capturé, un phototrou h• est aussi formé, qui lui aussi doit être neutralisé. La durée de vie d’un phototrou n’est pas reliée à celle du photoélectron. Cela suggère un mécanisme de capture différent. Malinowski suggère que le piège à trou peut être relié aux défauts comme le résultat d’impuretés : une fois capturés, les trous attirent les défauts mobiles et chargés négativement du réseau (les lacunes interstitielles d’argent Agv–)[14].
La formation de h.Agv diminue son énergie suffisamment pour stabiliser le complexe et réduire la probabilité de l’éjection d’un trou de retour dans la bande de valence. La constante d'équilibre entre complexe et le trou dans l’intérieur du cristal est estimée à 10-4[14].
Les recherches complémentaires sur les pièges à électron et trou démontrent que les impuretés peuvent aussi être un système de capture significatif. Par conséquent, les ions d’argent interstitiels peuvent ne pas être réduits. Ces pièges sont en réalité des mécanismes de perte et sont considérés comme inefficaces. Par exemple, l’oxygène atmosphérique peut interagir avec des photoélectrons pour former des espèces O2– qui peuvent réagir avec un trou[7]. Les impuretés sous forme d’ions métalliques comme le cuivre (I), le fer (II) et le cadmium (II) ont démontré leur capacité de capture de trou dans le bromure d’argent.
- Chimie de la surface cristalline
Une fois que les complexes-trous sont formés, ils diffusent sur la surface du grain en raison des gradients de concentration. Des études ont montré que la durée de vie des trous près de la surface des grains est beaucoup plus longue que ceux situés dans le volume, et ces trous sont en équilibre avec le brome absorbé. L’effet résultant entraîne la formation de plus de trous à la surface. De ce fait, comme les complexes-trous atteignent la surface, ils se dissocient[14] :
Par cette réaction d’équilibre, les complexes-trous sont constamment consommés à la surface, ceux-ci agissent en évier, jusqu’à ce qu’il n’y ait plus de trous dans le cristal. Ce mécanisme fournit la contrepartie à la réduction de Agi+ interstitiel en Agi0, donnant une équation globale[14] :
- Formation de l’image latente et photographie
Maintenant qu’une partie de la théorie a été présentée, le mécanisme du procédé photographique peut être abordé. En résumé, quand un film photographique est soumis à une image, les photons incidents à la surface du grain produisent des électrons qui réagissent avec les ions Agi+ pour former de l’argent sous forme métallique. Plus il y a de photons incidents sur un grain, plus grande sera la concentration en atomes d’argent (entre 5 et 50 atomes d’argent sur les ~1012 atomes du grain), dépendant de la sensibilité de l’émulsion. Le film a alors un gradient de concentration en atomes d’argent, fondé sur la variation d’intensité lumineuse traversant sa surface, et produisant une image latente[6],[14].
Pendant que ce procédé se produit, des atomes de brome sont également formés à la surface du cristal. Pour collecter le brome, une couche au-dessus de l’émulsion, appelée sensibilisateur, fait office d’accepteur pour le brome[14]. Pendant le développement du film, l’image latente est intensifiée par l’addition d’un réactif chimique, l’hydroquinone, qui réduit sélectivement les grains contenant déjà des atomes d’argent. L’hydroquinone est le révélateur[15]. Le processus, qui est sensible à la température et à la concentration, va complètement réduire les grains en argent métallique, intensifiant l’image latente d’un facteur 1010 à 1011. Cette étape démontre le gros avantage et la supériorité des halogénures d’argent sur d’autres systèmes : l’image latente, formée en quelques millisecondes, et invisible, est suffisante pour produire une image complète[6].
Après développement, le film est « fixé », étape pendant laquelle les sels d’argent restants sont enlevés pour éviter une réduction postérieure, donnant le négatif du film. Le réactif utilisé est du thiosulfate de sodium et réagit suivant l’équation suivante[6] :
Un nombre infini d’images positives peut être obtenu à partir d’un négatif en passant de la lumière au travers du négatif pour impressionner un papier recouvert d’émulsion photosensible[6].
Propriétés semi-conductrices
Quand le bromure d’argent est chauffé 100 °C en dessous de son point de fusion, un graphique d’Arrhenius (en fonction de la température) de la conductivité ionique montre une valeur croissante et puis une augmentation très importante. D’autres propriétés physiques comme le module élastique, la chaleur spécifique et la valeur de l’énergie du gap électronique augmentent également, suggérant que le cristal approche de l’instabilité[13]. Ce comportement, typique des semi-conducteurs, est attribué à la dépendance en température de la formation des défauts de Frenkel et, quand le graphique d’Arrhenius est normalisé par la concentration en défauts de Frenkel, il devient linéaire[13].
Voir aussi
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « silver bromide » (voir la liste des auteurs)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 16 juin 2008, 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, 2009, 90e éd., Relié, 2804 p. (ISBN 978-1-420-09084-0)
- (en) Bodie E. Douglas, Shih-Ming Ho, Structure and Chemistry of Crystalline Solids, Pittsburgh, PA, USA, Springer Science + Business Media, Inc., 2006, 346 p. (ISBN 0-387-26147-8), p. 64
- « Bromure d’argent » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- (en) N.N. Greenwood et A. Earnshaw, Chemistry of the Elements., New York: Permagon Press, 1984, p. 1185–1187
- (en) J.F. Hamilton, « Physical Properties of Silver Halide Microcrystals », dans Photographic Science and Engineering, vol. 18, no 5, 1974, p. 493–500
- (en) I. Leden et G. Persson, « The Solubility of Silver Chloride and Silver Bromide in Aqueous Ammonia and the Formation of Mixed Silver-Ammonia-Halide Complexes », dans Acta Chem. Scand., vol. 15, 1961, p. 607–614 [lien DOI]
- (en) L.M. Engelhardt, P.C. Healy, V.A. Patrick et A.H. White, « Lewis-Base Adducts of Group-11 Metal(I) Compounds. XXX. 3:1 Complexes of Triphenylphosphine With Silver(I) Halides », dans Aust. J. Chem., vol. 40, no 11, 1987, p. 1873–1880 [lien DOI]
- (en) S. Glaus et G. Calzaferri, « The band structures of the silver halides AgF, AgCl, and AgBr: A comparative study », dans Photochem. Photobiol. Sci, vol. 2, 2003, p. 398–401 [lien DOI]
- (en) David R. Lide, Handbook of Chemistry and Physics, CRC, 2005, 86e éd., Cleveland
- (en) R.W. Gurney et N.F. Mott, « The theory of the photolysis of silver bromide and the photographic latent image », dans Proc. Roy. Soc., vol. A164, 1938, p. 151–167
- (en) L.M. Slifkin, « The Physics of Lattice Defects in Silver Halides », dans Crystal Lattice Defects and Amorphous Materials, vol. 18, 1989, p. 81–96
- (en) J. Malinowski, « The Role of Holes in the Photographic Process », dans The Journal of Photographic Science, vol. 16, no 2, 1968, p. 57–62
- Chimie de la photographie, Laëtitia Breugelmans
Catégories :- Composé de l'argent
- Bromure
- Procédé photographique
Wikimedia Foundation. 2010.









 + NaX(aq).}](d/fad46308cc5641bbb16fa860b4dd5b13.png)