- 4-Méthylpentan-2-one
-
Méthylisobutylcétone
Méthylisobutylcétone 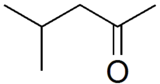
Structure de la méthylisobutylcétone Général Nom IUPAC 4-méthylpentan-2-one Synonymes MIBK, MIBC, hexone, isopropylacétone No CAS No EINECS PubChem FEMA SMILES InChI Apparence liquide incolore, d'odeur caractéristique.[1] Propriétés chimiques Formule brute C6H12O [Isomères] Masse molaire 100,1589 g∙mol-1
C 71,95 %, H 12,08 %, O 15,97 %,Propriétés physiques T° fusion -80,3 °C[2] T° ébullition 116 °C[2] Solubilité 20 g/l (eau, 20 °C)[2] Masse volumique (eau = 1) : 0.80[1] T° d’auto-inflammation 475 °C[2] Point d’éclair 14 °C[2] Limites d’explosivité dans l’air 1,2 - 8 Vol.%[2] Pression de vapeur saturante à 20 °C : 2.1 kPa[1] Point critique 33,9 bar à 302,4 °C[3] Thermochimie ΔfH0solide -381,5 kJ∙mol-1 [4] ΔvapH° 40,61 kJ∙mol-1 à 25 °C[4] Cp 211,9 J∙mol-1 [3] Précautions Directive 67/548/EEC 
Xn
FPhrases R : 11, 20, 36/37, 66, Phrases S : (2), 9, 16, 29, Transport - 1245 NFPA 704 SIMDUT[5] 
SGH[6] 

DangerÉcotoxicologie DL50 2.08 g/kg (rat, oral)[7] LogP 1.38[1] Unités du SI & CNTP, sauf indication contraire. La méthylisobutylcétone (souvent noté MIBC ou MIBK en anglais) est un solvant organique utilisé dans l'industrie chimique, plastique et des peintures.
Usage
L'application principale de ce composé chimique est la dilution de résines epoxy, vinyles et acriliques particulièrement dans l'industrie des peintures et vernis. Il est également utilisé comme solvant d'extraction de produits organiques solubles dans l'eau[8]. La méthylisobutylcétone n'est pratiquement pas utilisé comme réactif si ce n'est pour la production du 4-méthylpentan-2-ol par hydrogénation. Le peroxyde qui se forme naturellement à partir d'une solution est utilisé comme initiateur de polymérisation de l'éthylène[8].
Production et synthèse
La production de la méthylisobutylcétone peut se faire à partir de l'acétone. Quatre voies de synthèse sont possibles[8]:
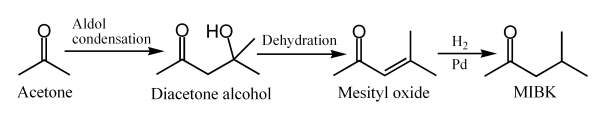
- En 3 étapes: 2 molécules d'acétone réagissent par une condensation aldolique pour former le 4-hydroxy-4-méthylpentane-2-one. Une déshydratation de ce dernier à l'aide d'un acide (acide sulfurique ou phosphorique pour une bonne sélectivité) donne l'oxyde de mésityle. Et la troisième étape consiste en une hydrogénation à l'aide d'hydrogène et d'un catalyseur tel le palladium. Cette méthode est la plus utilisée industriellement.
- En 2 étapes: Les 2 molécules d'acétone réagissent pour donner directement l'oxyde de mésityle en une seule étape. Cette réaction nécessite des catalyseurs tels les chromite de cuivre ou le phosphate de zirconium. Suit l'hydrogénation avec le palladium ou l'oxyde d'aluminium. Le 4-méthylpentan-2-ol est formé comme coproduit.
- En 1 étape: L'acétone est directement transformé en méthylisobutylcétone à l'aide d'un échangeur de cation et du palladium comme catalyseurs. L'acétone et l'hydrogène réagissent ensemble à 130 °C à une pression comprise entre 0.5 et 5 MPa. La sélectivité est supérieure à 95% pour une conversion inférieure à 50%.
- Comme co-produit de la déshydrogénation du propan-2-ol pour la production de l'acétone.
Notes et références
- ↑ a , b , c et d METHYLISOBUTYLCETONE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ a , b , c , d , e et f 4-Methylpentan-2-one sur http://www.dguv.de/bgia/de/gestis/stoffdb/index.jsp. Consulté le 15 janvier 2009
- ↑ a et b Methyl isobutyl ketone sur http://www.nist.gov/. Consulté le 15 janvier 2009
- ↑ a et b Methyl isobutyl ketone sur http://www.nist.gov/. Consulté le 15 janvier 2009
- ↑ « Méthyl isobutyl cétone » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ Methyl isobutyl ketone sur http://sis.nlm.nih.gov/. Consulté le 15 janvier 2009
- ↑ a , b et c Hardo Siegel, Manfred Eggersdorfer, Ullmann's Encyclopedia of Industrial Chemistry, Ketones, Wiley-VCH Verlag GmbH & Co, 2002
- Portail de la chimie
Catégories : Produit chimique nocif | Produit chimique facilement inflammable | Cétone | Solvant
Wikimedia Foundation. 2010.

