- Bisulfite
-
Un bisulfite est un composé chimique contenant l'anion bisulfite, ou hydrogénosulfite selon l'appellation recommandée par l'IUPAC, de formule brute HSO3-. Le bisulfite de sodium NaHSO3 est un exemple de bisulfite.
Propriétés chimiques
Les bisulfites sont généralement préparés en traitant des solutions alcalines avec un excès de dioxyde de soufre SO2 :
L'anion HSO3- est la base conjuguée de l'acide sulfureux H2SO3 :
L'acide sulfureux ne peut être isolé à l'état pur et ne semble pas non plus exister en solution, de sorte que l'équilibre le plus cohérent avec les mesures spectroscopiques serait :
HSO3- est une espèce chimique faiblement acide, avec un pKa de 6,97 ; sa base conjuguée est l'ion sulfite SO32- :
Les bisulfites sont des agents réducteurs, comme le sont les sulfites et le dioxyde de soufre, qui contiennent tous du soufre à l'état d'oxydation +4.
Structure
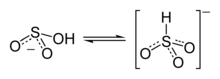
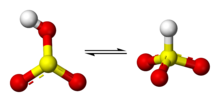
La plupart des mesures suggèrent que l'hydrogène de l'ion bisulfite est lié à l'atome de soufre, donnant lieu à une symétrie C3v, établie par diffractométrie de rayons X et, en solution aqueuse, par spectroscopie Raman (ν(S–H) = 2 500 cm−1). Certaines mesures de spectroscopie RMN à l'oxygène 17 suggèrent cependant l'existence de deux tautomères de HSO3 en équilibre dynamique, le premier à symétrie C3v (liaison H–S), le second à symétrie Cs (liaison H–O)[1].
Notes et références
- (en) D. A. Horner et R. E. Connick, dans Inorg. Chem. 25, 2414-7 (1986).
Wikimedia Foundation. 2010.