- Sulfure d'ammonium
-
Sulfure d'ammonium 
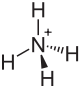
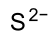
Général Nom IUPAC sulfure d'ammonium No CAS No EINECS SMILES InChI Apparence liquide incolore à jaunâtre, odeur proche du sulfure d'hydrogène (œuf pourri) Propriétés chimiques Formule brute H8N2S Masse molaire[1] 68,142 ± 0,006 g·mol-1
H 11,83 %, N 41,11 %, S 47,06 %,Propriétés physiques Masse volumique 0 997 g·cm-3 (20 °C)[2] Limites d’explosivité dans l’air 4 Vol.-% - 46 Vol.-%[2] Pression de vapeur saturante 546 mbar (20 °C)[2] Précautions Directive 67/548/EEC 
CPhrases R : 10, 31, 34, Phrases S : 26, 36/37/39, 45, Transport[2] 86 2683 Unités du SI & CNTP, sauf indication contraire. Le sulfure d'ammonium est le sel d'ammonium du sulfure d'hydrogène. Il a pour formule (NH4)2S et appartient à la famille des sulfures.
Sommaire
Occurrence
Dans la nature, c'est un produit du processus de décomposition. Il est aussi présent sous forme gazeuse dans les nuages de l'atmosphère de jupiter.
Propriétés
C'est un composé relativement instable (cristaux se décomposant à -18 °C, mais qui existe et est plus stable en solution aqueuse. Avec un pKa dépassant 15[3], l'ion hydrosulfure ne peut être déprotoné de façon significative par l'ammoniac. Ainsi, de tells solutions consistent principalement en un mélange d'ammoniac et d'hydrosulfure d'ammonium (NH4)SH. Il a une odeur nauséabonde, proche de celle du sulfure d'hydrogène (œuf pourri), et ses solutions acqueuses peuvent être dangereuses précisément en émettant du H2S[4].
Synthèse
Le sulfure d'ammonium peut être synthétisé par réaction du sulfure d'hydrogène avec l'ammoniac (gazeux ou en solution aqueuse) en excès.
Utilisations
Le sulfure d'ammonium est souvent utilisé en analyse qualitative non-organique; il permet, en se liant avec le cation métallique lourd (nickel, cobalt, fer, manganèse, chrome, aluminium ou zinc) d'un échantillon inconnu de le faire précipiter, et d'ainsi d'aider à les identifier par des tests de détection.
Le sulfure d'ammonium est aussi utilisé dans le développement photographique, pour appliquer la patine de bronze et dans la fabrication textile.
En raison de son odeur nauséabonde, il est un ingrédient actif de nombreux accessoires de farces et attrapes, et en particulier de certaines boules puantes.
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Entrée de « Ammonium sulfide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 04/02/10 (JavaScript nécessaire)
- Meyer B, Ward K, Koshlap K, Peter L "Second dissociation constant of hydrogen sulfide" Inorganic Chemistry, (1983). volume 22, pp. 2345.DOI:10.1021/ic00158a027
- (en) Material Safety Data Sheet « Ammonium Sulfide Solutions. »
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Ammoniumsulfid » (voir la liste des auteurs)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Ammonium sulfide » (voir la liste des auteurs)
Wikimedia Foundation. 2010.




