- XeO4
-
Tétraoxyde de xénon
Tétraoxyde de xénon 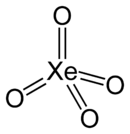
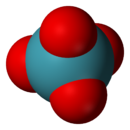
Structure du tétraoxyde de xénonGénéral No CAS Propriétés chimiques Formule brute XeO4 Masse molaire 195,291 g∙mol-1
O 32,77 %, Xe 67,23 %,Propriétés physiques T° fusion -35,9 °C (explosion) Unités du SI & CNTP, sauf indication contraire. Le tétraoxyde de xénon est un solide cristallin de couleur jaune de formule XeO4 qui n'est stable qu'en-dessous de -35,9 °C[1],[2] ; au-dessus de cette température, il se décompose en explosant pour libérer du xénon et de l'oxygène. Dans la molécule XeO4, le xénon est à l'état d'oxydation +8 tandis que l'oxygène est à l'état d'oxydation -2. L'oxygène est le seul élément connu à pouvoir porter le xénon à son état d'oxydation le plus élevé ; le fluor s'arrête à l'état +6 avec l'hexafluorure de xénon XeF6, sans doute pour des raisons d'encombrement stérique.
Propriétés chimiques et synthèse
Le tétraoxyde de xénon explose au-dessus de -35,9 °C, avec une ΔH = -643 kJ/mol :
- XeO4 → Xe + 2 O2
Deux autres composés du xénon avec un état d'oxydation +8 s'obtiennent en faisant réagir du tétraoxyde de xénon avec de l'hexafluorure de xénon XeF6 : le trioxydifluorure de xénon XeO3F2 et le dioxytétrafluorure de xénon XeO2F4, qu'on peut détecter par spectrométrie de masse.
Toutes les méthodes de préparation partent des perxénates, qu'on obtient des xénates selon deux méthodes possibles. La première est la dismutation de deux xénates en un perxénate et du xénon :
La seconde est l'oxydation de deux xénates avec de l'ozone :
Le perxénate de baryum Ba2XeO6 réagit avec l'acide sulfurique H2SO4 pour former du sulfate de baryum BaSO4 avec de l'acide perxénique H4XeO6, lequel donne le tétraoxyde de xénon par déshydratation :
Sinon, l'acide perxénique se dismute lentement en oxygène et acide xénique :
Notes et références
- ↑ H.Selig , J. G. Malm , H. H. Claassen , C. L. Chernick , J. L. Huston, « Xenon tetroxide -Preparation + Some Properties », dans Science, vol. 143, 1964, p. 1322 [texte intégral lien PMID lien DOI]
- ↑ J. L. Huston, M. H. Studier, E.N. Sloth, « Xenon tetroxide - Mass Spectrum », dans Science, vol. 143, 1964, p. 1162 [texte intégral lien PMID lien DOI]
Article connexe
- Portail de la chimie
Catégories : Composé du xénon | Oxyde
Wikimedia Foundation. 2010.
