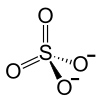
- BaSO4
-
Barite
Barite 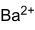
Général Synonymes Blanc fixe
sulfate de baryumNo CAS No EINECS PubChem SMILES InChI Apparence cristaux inodores, sans gout, blancs ou jaunatres ou poudre.[1] Propriétés chimiques Formule brute BaSO4 Masse molaire 233,39 g∙mol-1
Ba 58,84 %, O 27,42 %, S 13,74 %,Propriétés physiques T° fusion (décomposition) : 1 600 °C[1] Solubilité 2,5 mg/l dans l'eau à 20 °C Masse volumique 4.5 g/cm³[1] Précautions Directive 67/548/EEC Phrases S : 22, 24/25, SIMDUT[2] Produit non contrôlé Barite
CatégorieVII : sulfates, sélénates tellurates, chromates, molybdates, tungstates
Barite Identification Couleur incolore, parfois blanc, jaune Classe cristalline ou groupe d'espace dipyramidale
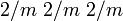
Système cristallin orthorhombique Clivage {001}, {210} et {010} Habitus cristaux aplatis selon (001),
parfois lamellairesFracture irrégulière Échelle de Mohs 3 - 3,5 Éclat vitreux à résineux Propriétés optiques Indice de réfraction α=1,634-1,637 β=1,636-1,638 γ=1,646-1,648 Biréfringence Δ=0,012 ; biaxe positif Dispersion 2vz ~ 36 - 38° Polychroïsme incolore Trait blanc Autres propriétés Densité 4,48 Fusibilité fond à la flamme et donne une boule blanche Solubilité soluble dans H2SO4 Caractères distinctifs Comportement chimique colore la flamme en rouge carmin Magnétisme aucun Radioactivité aucune Unités du SI & CNTP, sauf indication contraire. La barite, baryte ou barytine est un minéral composé de sulfate de baryum de formule BaSO4.
Son nom est dérivé du grec βαρύς signifiant lourd. Il est utilisé pour la première fois au XIXe siècle pour caractériser un minéral qui formait une gangue dans certains gîtes métallifères.
D’origine hydrothermale, la barite souvent se présente en mélange isomorphe avec l'anglésite et la célestine.
Sommaire
Gisements
On trouve la barytine dans les filons de basse température avec fluorine, blende, galène et sulfosels de plomb, ainsi qu'en lentilles dans les calcaires, comme ciment dans les grès et arkoses, et dans les sources thermales. D'importants gisements de barytine se situent dans des paléokarsts, à l'interface entre socle et couverture sédimentaire.
Utilisations
Produit opaque aux rayons X, il est utilisé en médecine pour visualiser le cheminement du bol alimentaire dans le tube digestif. Il permet ainsi de mettre en évidence des fausses routes ou des fistules.
La barite est une des principales sources d'obtention de baryum (toxique).
Elle a été également utilisée comme base pour la composition de certaines peintures (pour artistes notamment) : avec un pigment toxique le jaune de baryum ou « jaune de baryte » parfois improprement[3] dénommé « jaune d'outremer » (peut-être pour éviter d'évoquer sa toxicité), composé de chlorure de baryum, de bichromate de potassium et de sodium[4]. Ce pigment a été créé par Leclaire et Barruel au début du XIXe siècle. Il ne semble plus utilisé, car toxique et verdissant peu à peu lorsqu'exposé à la lumière. Il présenterait aussi des incompatibilités avec certaines couleurs[5].
La barite a aussi été utilisée dans le papier et par l'industrie pétrolière comme boue lourde pour augmenter la densité des fluides de forages et éviter les fuites des gaz.
La barite peut également être ajoutée à la composition du béton afin d'augmenter considérablement sa densité. Ce type de béton est généralement utilisé pour la construction de bâtiments servant pour des tirs radiologiques, ou certains bâtiments des centrales nucléaires.
Voir aussi
Références
- ↑ a , b et c SULFATE DE BARYUM, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Sulfate de baryum » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Normalement les outremers sont fabriqués à partir d'aluminium et de silicium
- ↑ source André Béguin, in [1]
- ↑ Bontinck cité par A. Béguin repris in [2]
Liens externes
Notes et références
- Portail des minéraux et roches
- Portail de la chimie
Catégories : Composé du baryum | Sulfate (minéral)
Wikimedia Foundation. 2010.





