- Séquençage par spectrométrie de masse
-
Voir aussi Séquençage des protéines
La spectrométrie de masse MS/MS permet de déterminer la séquence des peptides sur quelques dizaine d'acides aminés. Couplé avec des techniques de digestion (enzymatiques ou chimiques) et avec des techniques de séparation (chromatographie en phase liquide à haute performance par exemple), il est possible de caractériser une protéine.
Sommaire
Principe de la fragmentation
La fragmentation est le processus permettant de séparer chaque acide aminé d'un peptide. Pour des raisons de stabilité des liaisons, les séquences polypeptidiques se clivent préférentiellement au niveau des liaisons peptidiques. Il existe cependant des mécanismes complexes qui produisent d'autres types ruptures de liaison, ce qui peut rendre difficile la lecture des spectres de masses et la détermination de la séquence.
- Spectrométrie de masse MS/MS
Pour fragmenter les peptides, on utilise soit plusieurs analyseurs couplés en série (spectromètre de type triple quadripoles QqQ ou de type quadripole-temps de vol Q-TOF) ou un analyseur capable de réaliser plusieurs analyses en série (spectromètre de masse de type trappe ionique IT ou de type résonance cyclotronique FT-ICR).
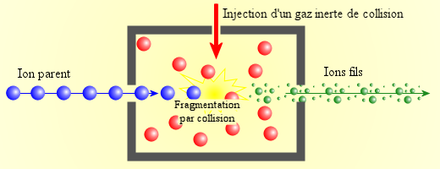
- Le premier analyseur permet de sélectionner un ion à fragmenter (appelé "ion parent") et d'exclure tous les autres ions présents.
- Cet ion parent est fragmenté, en général par collision avec un gaz inerte (c'est-à-dire qui ne réagit pas chimiquement avec l'ion parent) dans une cellule de collision. Cette fragmentation permet de "casser" les liaisons moléculaires, en particulier les liaisons peptidiques, et de produire des "ions fils".
- Les ions fils sont ensuite séparés par le second analyseur puis détectés.
- Mode d'analyse possible
Il existe plusieurs mode d'analyse en spectrométrie de masse en tandem :
- Fragment ion scan (ou Product ion scan' ou Daughter scan)
- Dans ce mode, un ion parent de rapport m/z donné est sélectionné. Il est fragmenté puis l'ensemble de la gamme de masse est balayée pour analyser les ions fils produits.
- Precursor ion scan (ou Parent scan)
- Dans ce mode, un seul ion fils de rapport m/z donné est analysé. L'ensemble de la gamme de masse des ions parents est balayé. Ce mode permet d'analyser les ion parents qui produisent spécifiquement un ion fils donné.
- Neutral ion scan
- Dans ce mode, les ions parents et les ions fils sont analysés sur l'ensemble de la gamme de masse. On choisit un masse m1, on balaye les ions parents sur l'ensemble de la gamme de masse et l'on analyse les ions fils produits de masse m2-m1. Ce mode permet d'étudier les ions parents qui peuvent perdre un fragment neutre (et qui ne peut donc pas être analaysé par le second balayage). Par exemple, on peut analysé les alcools en effectuant recherchant une différence de masse de 18 Da.
- Sans balayage
- Dans ce mode, la masse de l'ion parent et de l'ion fils est déterminé. Ce mode est utilisé en quantification pour mesurer la quantité d'une molécule donnée.
- Type de fragmentation
Les fragmentations peuvent être classé en fonction de leurs types :
- Fragmentation spontanée des ions métastables ou fragmentation induite par collision sur une surface (SID Surface Induced Dissociation), avec un gaz inerte (CID Collision Induced Dissociation) ou un gaz réactif (RIM Reactant Ion Monitoring)
- Fragmentation de haute énergie (par exemple avec un TOF/TOF), produisant beaucoup de rupture de liaisons, ou fragmentation de basse énergie, minimisant les ruptures de liaisons non peptidiques.
- Stabilité des ions
En fonction de l'énergie interne des ions, les ions se fragmentent à différents temps de vie :
- ion stable : plus de 10-6 s
- ion métastable : entre 10-6 et 10-7 s
- ion instable : moins de 10-7 s
Série de fragmentation

M = M(n AA) + M(H) + M(OH)
Code à 1 lettre Code à 3 lettres Acide aminé Masses Acides aminés
modifiésA Ala Alanyl 71 113 (Acétylation)
297 (Biotinylation)C Cys Cystyl 103 160 (Carbamidométhylation)
161(Carboxyméthyl)
174 (Propionamidation)
202 (NIPCAM)
208 (S-pyridyléthylation)D Asp Aspartyl 115 129 (Méthylestérification)
137 (Sodiation)E Glu Glutamyl 129 111 (Pyro-glu)
143 (Méthylestérification)
151 (Sodiation)F Phe Phénylalanyl 147 - G Gly Glycyl 57 - H His Histidyl 137 153 (Oxydation) I Ile Isoleucyl 113 - K Lys Lysyl 128 255 (SMA) L Leu Leucyl 113 - M Met Méthionyl 131 147 (Oxydation)
163 (Sulfonation)N Asn Asparagyl 114 - P Pro Prolyl 97 - Q Gln Glutamyl 128 111 (Pyro-glu en N-term) R Arg Arginyl 156 - S Ser Séryl 87 167 (Phosphorylation) T Thr Thréonyl 101 181 (Phosphorylation) V Val Valyl 99 - W Trp Tryptophanyl 186 206 (Oxydation) Y Tyr Tyrosyl 163 243 (Phosphorylation) Avec des modifications N terminale Modification Masse Acétylation + 42 Da Biotinylation + 226 Da Carbamylation + 43 Da Formylation + 28 Da SMA + 127 Da Avec des modifications C terminale Modification Masse Méthylestérification + 14 Da Sodiation + 22 Da Fragmentation au niveau de la liaison peptidique
Fragmentation d'une seule liaison
Fragmentation N terminale
- Série d'ions a
La fragmentation de la série a produit des ions aldimines :

M = M(n AA) + M(H) - M(CO) = M(n AA) - 27
La série a* dérive de la série a par la perte d'un groupe NH3 :
M = a - M(NH3) = a - 17
La série a0 dérive de la série a par la perte d'un groupe H2O :
M = a - M(H2O) = a - 18
- Série d'ions b
La fragmentation de la série b produit des ions acylium :

M = M(n AA) + M(H) = M(n AA) + 1
La série b* dérive de la série b par la perte d'un groupe NH3 :
M = b - M(NH3) = b - 17
La série b0 dérive de la série b par la perte d'un groupe H2O :
M = b - M(H2O) = b - 18
- Extrémité N terminale
Le fragment peptidique de plus faible poids moléculaire de la série b correspond à l'extrémité N terminal du peptide parent. Il correspond à la formule :
R NH2-CH-CO+et il donne un pic avec un rapport m/z :
m/z = M(H) + M(aa) = M(aa) + 1- Extrémité C terminale
Le fragment peptidique de plus haut poids moléculaire de la série b correspond à l'extrémité C terminal du peptide parent [M+H]+. Il correspond à la formule :
R NH2-...-(CH)-...-CO+La différence de masse entre ce fragment et le peptide parent correspond donc au dernier acide aminé aan :
m/z = M(ion parent M[M+H]+) - M(fragment peptidique) = ( M(H) + ΣM(aa) + M(aan + M(OH) + M(H+) ) - ( M(H) + ΣM(aa) ) = M(aan ) + 18En particulier, dans le cas d'une digestion trypsique, l'acide aminé C terminal correspond à une lysine ou une arginine. En fonction de cet acide aminé, on observe un pic qui apparait aux différence suivante par rapport au rapport m/z de l'ion parent [M+H]+ :
m/z = 146 pour la lysine
et
m/z = 174 pour l'arginine
- Série d'ions c
La fragmentation de la série c produit des ions amino :

M = M(n AA) + M(H) + M(NH3) = M(n AA) + 18
Fragmentation C terminale
- Série d'ions x
La fragmentation de la série x produit des ions acylium :

M = M(n AA) + M(CO) + M(OH) = M(n AA) + 45
- Série d'ions y
La fragmentation de la série y produit des ions amino :

M = M(n AA) + M(2H) + M(OH) = M(n AA) + 19
La série y* dérive de la série y par la perte d'un groupe NH3 :
M = y - M(NH3) = y - 17
La série y0 dérive de la série y par la perte d'un groupe H2O :
M = y - M(H2O) = y - 18
- Extrémité C terminale
Le fragment peptidique de plus faible poids moléculaire de la série y correspond à l'extrémité C terminal du peptide parent. Il correspond à la formule :
R NH3+-CH-COOHet il donne un pic avec un rapport m/z :
m/z = 2M(H) + M(aa) + M(OH) = M(aa) + 19En particulier, dans le cas d'une digestion trypsique, l'acide aminé C terminal correspond à une lysine ou une arginine. En fonction de cet acide aminé, on observe un pic aux valeurs :
m/z = 147 pour la lysine
et
m/z = 175 pour l'arginine
- Extrémité N terminale
Le fragment peptidique de plus haut poids moléculaire de la série y correspond à l'extrémité N terminal du peptide parent. Il correspond à la formule :
R NH3+-...-(CH)-...-COOHLa différence de masse entre ce fragment et l'ion parent [M+H]+ correspond donc au premier acide aminé aa1 :
m/z = M(ion parent M[M+H]+) - M(fragment peptidique) = ( M(H) + ΣM(aa) + M(aa1 + M(OH) + M(H+) ) - ( 2M(H) + ΣM(aa) + M(OH) ) = M(aa1 )- Série d'ions z
- La fragmentation de la série z produit des carbocations :
Fragmentation de la série zM = M(n AA) - M(NH) + M(OH) = M(n AA) + 2
Fragmentation de deux liaisons
- Ion de fragmentation interne
Ces ions correspondent au clivage de deux liaisons peptidiques. Ces clivages correspondent en général à des fragmentations de types b et y et forment des ions amino-acylium :

M = M(n AA) + M(2H) = M(n AA) + 2
Parfois, les clivages correspondent à des fragmentations de types a et y et produisent des ions amino-iminium :

M = M(n AA) + M(H) - M(CO) = M(n AA) - 27
- Ion iminium
Lorsque qu'une fragmentation de type a est voisine d'une fragmentation de type y, il se forme un ion iminium :

M = M(AA) + M(H) - M(CO) = M(AA) - 27
Les ions iminiums apparaissent dans un spectre MS/MS à des masses inférieurs à 200 Da. Ils permettent de connaître la composition en acide aminé du peptide fragmenté.
Acide aminé Code à 3 lettres Code à 1 lettres Masse Ion iminium dérivé Acide aspartique Asp D 88 70 Acide glutamique Glu E 102 - Alanine Ala A 44 - Arginine Arg R 129 59, 70, 73, 87, 100, 112 Asparagine Asn N 87 70 Cystéine Cys C 76 - Glutamine Gln Q 101 56, 84, 129 Glycine Gly G 30 - Histidine His H 110 82, 121, 123, 138, 166 Isoleucine Iso I 86 44, 72 Leucine Leu L 86 44, 72 Lysine Lys K 101 70, 84, 112, 129 Méthionine Met M 104 61 Phénylalanine Phe F 120 91 Proline Pro P 70 - Sérine Ser S 60 - Thréonine Thr T 74 - Tryptophane Trp W 159 77, 117, 130, 132, 170, 171 Tyrosine Tyr Y 136 91, 107 Valine Val V 72 41, 55, 69 Fragmentation des chaînes latérales
- Série d'ions d
Un ion de la série d est formé par la perte d'une partie de la chaîne latérale de l'acide aminé C terminal d'un ion de la série a.

M = M(AA) + M(H) - M(CO) - M(Rperdu) = M(AA) - 27 - M(Rperdu)
- Série d'ions v
Un ion de la série v est formé par la perte de la chaîne latérale de l'acide aminé N terminal d'un ion de la série y.

M = M(AA) + M(OH) - M(Rperdu) = M(AA) + 17 - M(Rperdu)
- Série d'ions w
Un ion de la série w est formé par la perte d'une partie de la chaîne latérale de l'acide aminé N terminal d'un ion de la série z.

M = M(AA) + M(OH) - M(NH) - M(Rperdu) = M(AA) + 2 - M(Rperdu)
Liste des modifications des protéines
Wikimedia Foundation. 2010.