- Syndrome de Wolff-Parkinson-White
-
Syndrome de Wolff-Parkinson-White
Classification et ressources externesDécrit en 1930 par les Docteurs Wolff, Parkinson et White[1], le syndrome de Wolff-Parkinson-White (WPW) est un trouble du rythme cardiaque secondaire à un syndrome de pré-excitation électrique ventriculaire.
Sommaire
Physiologie
Chez les individus sains, l'activité électrique du cœur est initiée au niveau du nœud sinusal (localisé à la jonction entre la veine cave supérieure et l'oreillette droite). L'onde de dépolarisation se propage alors vers le nœud auriculo-ventriculaire (situé à la partie basse de l'oreillette droite), puis vers les ventricules cardiaques par l'intermédiaire du faisceau de His.
Le nœud auriculo-ventriculaire agit comme une « barrière », limitant l'activité électrique qui atteint les ventricules cardiaques. Cette fonction est essentielle car si le signal électrique généré au niveau des oreillettes s'accroît (comme c'est le cas au cours de la fibrillation auriculaire ou du flutter), le nœud auriculo-ventriculaire va limiter l'activité électrique qui sera conduite aux ventricules.
Par exemple, si les oreillettes sont électriquement activées à 300 battements par minute, environ la moitié des impulsions électriques seront bloquées par le nœud auriculo-ventriculaire ; ainsi, les ventricules seront activés à environ 150 battements par minute (donnant ainsi une fréquence cardiaque de 150/minute).Une autre fonction importante du nœud auriculo-ventriculaire est de pouvoir ralentir les impulsions électriques. Cela se traduit sur l'électrocardiogramme par l'espace PR, qui correspond au temps séparant l'activation des oreillettes (onde P) et l'activation des ventricules cardiaques (complexe QRS).
Physiopathologie
Les individus présentant un syndrome de Wolff-Parkinson-White possèdent une voie de conduction auriculo-ventriculaire supplémentaire, appelée faisceau de Kent. Cette voie accessoire correspond à une communication électrique anormale entre les oreillettes et les ventricules cardiaques.
Cette voie ne partage pas les propriétés du nœud auriculo-ventriculaire citées ci-dessus. Les ventricules ne sont pas capables, lorsque les impulsions électriques s'accroissent, de se contracter de façon uniforme aussi rapidement et vont ainsi fibriller.Cette voie accessoire va, dans certaines circonstances, « court-circuiter » le nœud auriculo-ventriculaire, aboutissant à une dépolarisation prématurée du ventricule.
En cas de fibrillation auriculaire, d'utilisation de digitaliques, d'inhibiteurs calciques, la conduction dans le nœud auriculo-ventriculaire est ralentie, orientant ainsi les influx nerveux vers cette voie accessoire. Ceci expose à un risque de tachyarythmie rapide et mal tolérée pouvant « dégénérer » en fibrillation ventriculaire.D'autres types de faisceaux accessoires peuvent exister :
- connexion directe entre l'oreillette et le faisceau de His (intervalle PR court, sans ondes delta) : syndrome de Lown-Ganong-Levine,
- faisceau connectant le faisceau de His (ou une de ses branches) directement avec le myocarde.
Causes
La cause de la présence de la voie accessoire est inconnue dans environ 95% des cas.
Il est décrit des formes familiales et deux gènes ont été identifiées dont les mutations provoquent le syndrome : PRKGD[2] et BMP2[3].
Le syndrome de Wolff-Parkinson-White est parfois associé à la neuropathie optique de Leber[4],[5], une maladie génétique liée à une atteinte de l'ADN mitochondrial.Épidémiologie
Son incidence est difficile à préciser car un certain nombre de syndromes de Wolff-Parkinson-White ne sont pas diagnostiqués.
Les hommes sont plus fréquemment atteints que les femmes. Ce syndrome peut toucher toutes les tranches d'âges mais se rencontre plus fréquemment chez l'enfant et l'adulte jeune.Diagnostic
Clinique
Environ la moitié des sujets restent asymptomatiques tout au long de leur vie[6].
Dans le cas contraire, il peut se manifester par des crises de tachycardie paroxystique de type Bouveret. Il peut également entraîner des syncopes ou une mort subite par fibrillation auriculaire compliquée de fibrillation ventriculaire.
Électrocardiogramme
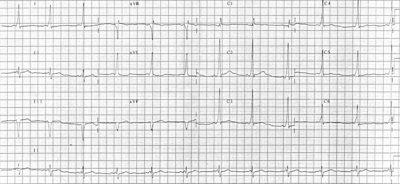
Lorsque le rythme est sinusal (rythme cardiaque normal), on retrouve un aspect caractéristique de ce syndrome : les ondes delta : la pente au début de la branche montante de l’onde R n’est pas aussi raide que normalement. Après quelques centièmes de seconde, la pente redevient normale. Cette onde delta, qui est surajoutée avant et pendant la phase initiale de l’onde R, entraîne un raccourcissement de l’intervalle PR et un allongement de la durée du complexe QRS (élargissement des complexes QRS), ainsi que des troubles de la repolarisation.
Cet aspect caractéristique est dû au fait que chez les sujets atteints d'un syndrome de Wolff-Parkinson-White, l'activité électrique initiée au niveau du nœud sinusal est propagée non seulement via le nœud auriculo-ventriculaire mais conjointement par la voie accessoire. Cette seconde voie ne possédant pas les propriétés du nœud auriculo-ventriculaire (voir Physiopathologie), l'impulsion électrique active les ventricules en premier par la voie accessoire, et immédiatement après par la voie normale : ce qui explique l'espace PR court et l'onde delta.
En cas de fibrillation auriculaire, le syndrome peut être suspecté en raison de la fréquence ventriculaire particulièrement rapide, pouvant dépasser les 200 par minute avec des complexes QRS élargis et variables.
L'électrocardiogramme peut être parfois normal, l'onde delta n'étant que transitoire, soit en raison d'une période réfractaire longue de la voie accessoire, soit par conduction cachée.
Autres examens
Un test à l'effort permet de voir si l'aspect de l'onde delta persiste ou non avec l'augmentation de la fréquence cardiaque induite à l'effort.
Une exploration électrophysiologique peut être faite, soit par voie endo-cavitaire, par introduction de sondes à l'intérieur du cœur sous contrôle radiologique, ou par voie trans-œsophagienne[7], par introduction d'une sonde dans l'œsophage permettant de stimuler l'oreillette gauche à travers sa paroi. Le but essentiel est de déterminer la période réfractaire de la voie accessoire, qui, si elle est basse, comporte un risque de complications graves à long terme. Cette période réfractaire est calculée par stimulation de l'oreillette à fréquence croissante, jusqu'à disparition de l'aspect de l'onde delta sur l'électrocardiogramme se surface, et par calcul de la fréquence cardiaque maximale en fibrillation auriculaire, cette dernière étant provoquée par une salve de stimulation rapide.
Prise en charge
Evaluation du risque
La décision de traiter ou non un sujet présentant un syndrome de Wolff-Parkinson-White est prise après avoir évalué pour chaque individu le risque de mort subite. Celle-ci survient par un trouble du rythme ventriculaire sur un accès de fibrillation auriculaire. Ce risque a été identifié dès 1971[8]. Son incidence annuelle est globalement d'environ un cas pour 1000[9], mais des chiffres allant jusqu'à 5 pour mille ont été cités[10].
Un bon interrogatoire doit être réalisé à la recherche d'épisodes inexpliqués de syncope ou de palpitations, pouvant alors être dus à des épisodes précoces de tachycardie en rapport avec la voie accessoire. Le caractère asymptomatique du syndrome n'est pas forcémment un critère de bénignité, la mort subite pouvant être la première manifestation de la maladie[11].
Les personnes présentant un syndrome de Wolff-Parkinson-White et dont les ondes delta disparaissent avec l'augmentation du rythme cardiaque (par exemple à l'effort) sont à faible risque de mort subite[12]. La disparition de l'onde delta montre que la voie accessoire ne peut conduire des impulsions électriques à un rythme rapide.
On considère qu'il existe un haut risque de mort subite lorsque la période réfractaire de la voie accessoire est courte[13] (mais la spécificité de ce test serait faible[14]), lorsqu'il existe plusieurs voies accessoires, en cas de localisation septale[15] ou droite de la voie accessoire[16].
Les individus présentant n'importe laquelle de ces caractéristiques doivent être traités.Traitement
Les sujets présentant une tachyarythmie mal tolérée doivent bénéficier d'une défibrillation.
Le traitement radical du syndrome de Wolff-Parkinson-White est la destruction de la voie accessoire par radiofréquence ; c'est le traitement de référence et de première intention chez le patient symptomatique depuis le début des années 1990[17]. L'ablation par radiofréquence est proposé aux sujets présentant un syndrome de Wolff-Parkinson-White symptomatique malgré le traitement médicamenteux et ceux qui sont considérés comme « à risque » de mort subite[18]. Si l'ablation par radiofréquence de la voie accessoire est réalisée avec succès, le sujet est généralement considéré comme guéri[19],[20]. L'âge optimal pour proposer ce type de traitement n'est pas clairement établi, mais cette procédure peut être faite chez un enfant jeune.
L'activité physique, même de haut niveau, n'est pas déconseillée si le sujet est considéré comme à bas risque de mort subite[21].
Notes et références
- Scheinman MM, History of Wolff-Parkinson-White syndrome, Pacing Clin Electrophysiol, 2005;28:152-156
- Gollob MH, Green MS, Tang AS et Als. Identification of a gene responsable for familial Wolff-Parkinson-White syndrome, N Engl J Med, 2001;344:1823-1831
- Lalani SR, Thakuria JV, Cox GF et Als. 20p12.3 Microdeletion predisposes to Wolff-Parkinson-White syndrome with variable neurocognitive deficits, J Med Genet, 2009;46:168–175
- Nikoskelainen E.K. Savontaus M.L. Huoponen K. Antila K. Hartiala J, Pre-excitation syndrome in Leber's hereditary optic neuropathy, Lancet, 1994;344:857-8
- Mashima Y. Kigasawa K. Hasegawa H. Tani M. Oguchi Y, High incidence of pre-excitation syndrome in Japanese families with Leber's hereditary optic neuropathy, Clinical Genetics, 1996;50:535-537
- Goudevenos JA, Katsouras CS, Graekas G, et als. Ventricular pre-excitation in the general population: a study on the mode of presentation and clinical course, Heart, 2000;83:29–34
- Brembilla-Perrot B. Ghawi R. Dechaux J.P, Caractéristiques électrophysiologiques des syndromes de Wolff-Parkinson-White asymptomatiques, Arch Mal Cœur Vaiss, 1991;84:1549-1554
- Dreifus LS, Haiat R, Watanabe Y et als. Ventricular fibrillation. A possible mechanism of sudden death in patients and Wolff-Parkinson-White syndrome, Circulation, 1971;43:520–7
- Munger TM, Packer DL, Hammill SC et als. A population study of the natural history of Wolff-Parkinson-White syndrome in Olmsted County, Minnesota, 1953-1989, Circulation, 1993;87:866–73
- Pappone C, Santinelli V, Rosanio S et als. Usefulness of invasive electrophysiologic testing to stratify the risk of arrhythmic events in asymptomatic patients with Wolff-Parkinson-White pattern: results from a large prospective long-term follow-up study, J Am Coll Cardiol, 2003;41:239–44
- Timmermans C, Smeets JL, Rodriguez LM et als. Aborted sudden death in the Wolff-Parkinson-White syndrome, Am J Cardiol, 1995;76:492–4
- Wellens HJ, Pappone C, Santinelli V, When to perform catheter ablation in asymptomatic patients with a Wolff-Parkinson-White electrocardiogram, Circulation, 2005;112:2201-2216
- Bromberg BI, Lindsay BD, Cain ME, Cox JL, Impact of clinical history and electrophysiologic characterization of accessory pathways on management strategies to reduce sudden death among children with Wolff-Parkinson-White syndrome, J Am Coll Cardiol, 1996;27:690–695
- Gaita F, Giustetto C, Riccardi R, Mangiardi L, Brusca A, Stress and pharmacologic tests as methods to identify patients with Wolff-Parkinson-White syndrome at risk of sudden death, Am J Cardiol, 1989;64:487–490
- Timmermans C, Smeets JL, Rodriguez LM, Vrouchos G, Van den Dool A, Wellens HJ, Aborted sudden death in the Wolff-Parkinson-White syndrome, Am J Cardiol, 1995;76:492–494
- Harahsheh A, Du W, Singh H, Karpawich PP, Risk factors for atrioventricular tachycardia degenerating to atrial flutter/fibrillation in the young with Wolff-Parkinson-White, Pacing Clin Electrophysiol, 2008;31:1307–1312
- Traitement des tachycardies supra-ventriculaires
- Triedman J, Perry J, Van Hare G, Risk stratification for prophylactic ablation in asymptomatic Wolff-Parkinson-White syndrome, N Engl J Med, 2005;352:92-93
- Pappone C, Santinelli V, Manguso F et Als. A randomized study of prophylactic catheter ablation in asymptomatic patients with the Wolff-Parkinson-White syndrome, New England Journal of Medicine, 2003;349:1803-1811
- Antz M, Weiss C, Volkmer M, et als. Risk of sudden death after successful accessory atrioventricular pathway ablation in resuscitated patients with Wolff-Parkinson-White syndrome, J Cardiovasc Electrophysiol, 2002;13:231–6
- Zipes DP, Ackerman MJ, Estes NA et als. Task Force 7: arrhythmias, J Am Coll Cardiol, 2005;45:1354–63
Wikimedia Foundation. 2010.