- Slimicide
-
Acroléine
Acroléine 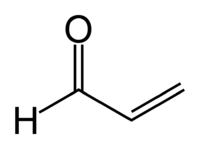
Général Nom IUPAC Propènal Synonymes 2-Propenal
Aldéhyde acrylique
AcrylaldéhydeNo CAS No EINECS Apparence liquide incolore à jaune, d'odeur âcre.[1] Propriétés chimiques Formule brute C3H4O [Isomères]
H2C=CH-CHOMasse molaire 56,0633 g∙mol-1
C 64,27 %, H 7,19 %, O 28,54 %,Propriétés physiques T° fusion -88 °C[1] T° ébullition 53 °C[1] Solubilité dans l'eau à 20 °C : 20 g/100 ml[1] Masse volumique (eau = 1) : 0.8[1],
1,94 (vapeur)T° d’auto-inflammation 234 °C[1] Point d’éclair -26 °C c.f.[1] Limites d’explosivité dans l’air en volume % dans l'air : 2.8-31[1] Pression de vapeur saturante à 20 °C : 29 kPa[1] Viscosité dynamique 0,33cP (25 °C) Précautions Directive 67/548/EEC 
T+
F
NPhrases R : 11, 24/25, 26, 34, 50, Phrases S : 23, 26, 28, 36/37/39, 45, 61, Transport - 1092 NFPA 704 SIMDUT[3] 


SGH[4] 



DangerClassification du CIRC Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[2] Écotoxicologie LogP 0.9[1] Unités du SI & CNTP, sauf indication contraire. L'acroléine est une substance chimique de formule brute C3H4O aussi connue sous divers noms comme propènal, prop-2-ènal,prop-2-èn-1-al, acraldéhyde, acrylaldéhyde, aldéhyde acrylique, acquinite, aqualin, aqualine, biocide, crolean, éthylène aldéhyde, magnacide, magnacide H ou slimicide.
Elle se présente sous la forme d'un liquide incolore à légèrement jaunâtre. C'est un aldéhyde (H2C=CH-CHO) extrêmement toxique par inhalation et ingestion, elle est le constituant de la papite. Les limites d'exposition atmosphérique de l'acroléine sont de l'ordre de 0,1 ppm (soit 250 microgrammes par mètre cube d'air). L'acroléine est un irritant majeur présent dans la fumée de cigarette ; sa concentration peut varier de 0,006 à 0,120 ppm en atmosphère enfumée.
Elle a pour origine l'incendie de matières plastiques (décès par suffocation), les fruits pourrissants, la décomposition de graisses. Elle se forme lorsque les acides gras présents dans les viandes se dégradent sous l’action de la chaleur (barbecues). Les acides gras à longues chaînes brisent les liens qui les liaient au glycérol, puis la molécule de glycérol perd deux molécules d’eau pour former l’acroléine. Elle contribue aussi au parfum des caramels préparés par chauffage en décomposition partielle du saccharose.
Sommaire
Propriétés
L'acroléine possède les propriétés dues au groupement aldéhyde et à la présence de la double liaison C=C (addition d'hydracides). Elle fait partie de la famille des aldéhydes alpha insaturés. C'est un composé instable qui se polymérise facilement à la lumière pour former du disacryl (solide plastique). Elle prend naissance à chaud dans les graisses et les huiles (d'où son nom : âcre-oléine).
L'industrie pharmaceutique et chimique des matières plastiques, utilisant l'alcool allylique (CH2=CH-CH2-OH) pourrait avoir un effet hépatotoxique suite à la formation d'acroléine par l'ADH, cela produirait la libération du fer de la ferritine qui induirait un processus de lipoperoxydation (Lauwerijs).
Préparation
On la prépare industriellement en passant des vapeurs de glycérol sur du sulfate de magnésium chauffé de 330 à 340 °C. On l'obtient également par cultures de Bacillus amaracrylus sur du glycérol.
L'acroléine est également préparée à l'aide d'un procédé industriel utilisant des catalyseurs composés de différents oxydes (molybdène, vanadium, nobium...). Ce procédé consiste en une oxydation sélective du propène en acroléine.
Utilisations
L'acroléine est utilisée pour la fabrication de matières plastiques, de parfums, et dans de nombreuses synthèses organiques. Elle est également utilisée comme intermédiaire réactionnel pour la préparation de la DL-méthionine. C'est un composé toxique, irritant la peau et les muqueuses, hautement lacrymogène, qui a été utilisé comme gaz de combat durant la Première Guerre mondiale.
Liens externes
Références
- ↑ a , b , c , d , e , f , g , h , i et j ACROLEINE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ « Acroléine » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Portail de la chimie
Catégories : Produit chimique très toxique | Produit chimique facilement inflammable | Produit chimique dangereux pour l'environnement | Produit chimique corrosif | Aldéhyde | Arme chimique
Wikimedia Foundation. 2010.

