- Sarcophagidae
-
 Sarcophagidae
Sarcophagidae
Sarcophaga sp. Classification Règne Animalia Embranchement Arthropoda Sous-embr. Hexapoda Classe Insecta Sous-classe Pterygota Infra-classe Neoptera Super-ordre Endopterygota Ordre Diptera Sous-ordre Brachycera Infra-ordre Muscomorpha selon ADW & ITIS
Cyclorrhapha selon A.Z.LehrerFamille Sarcophagidae
Haliday, 1853 Retrouvez ce taxon sur Wikispecies
Retrouvez ce taxon sur Wikispecies
D'autres documents multimédia
sont disponibles sur CommonsLes Sarcophagidae sont une famille de mouches de l'ordre des Diptères.
On évalue approximativement le nombre de ses espèces de 2 000 à 2 500 mais il est probablement beaucoup plus grand car leur taxinomie est encore très discutée. La famille Sarcophagidae est souvent associée aussi avec les familles Calliphoridae et Scathophagidae, elle est aussi parfois classée dans la super-famille des Sarcophagoidea. La recherche analytique de la morphologie du complexe génital des mâles a mis en évidence l’existence d’une grande série de taxons inconnus dans les collections diptérologiques plus anciennes. D'après certains auteurs, cela remettrait en cause l'exhaustivité des connaissances que l'on pensait avoir sur cette famille.
Les caractères majeurs qui illustrent l’appartenance des diptères à la famille Sarcophagidae sont :
- les antennes formées par trois articles et possédant une arista (sous-ordre Brachycera, Muscomorpha ou Cyclorrhapha) ;
- la présence de la suture frontale (division Schizophora) ;
- les écailles bien développées (section Calyptratae).
Ces caractères sont complétés par :
- les sternites abdominaux II et III sont libres et couvrent les marges des tergites ;
- les macrochètes posthuméraux sont au nombre de 1-2, la paire la plus extérieure manque ;
- le macrochète présutural est situé plus bas et plus proche des macrochètes notopleuraux que le plus extérieur macrochète posthumeral
- la nervure m1+2 (la nervure transversale antérieure, la nervure médiale 1+2 ou ta) est toujours présente et le cubitulus est fortement courbée en angle droit ou aigu ;
- les yeux sont glabres et très rarement poilus ;
- l’arista est plumeuse dans sa moitié basale, rarement pubescente ou glabre.
Les espèces de la famille Calliphoridae, dont les caractères majeurs montrent leur appartenance aux Cyclorrhapha, Schizophora ou Calyptratae, ont le corps métallique bleu, vert ou noir, l'arista plumeuse sur toute sa longueur, deux macrochètes notopleuraux dont le postérieur, le macrochète posthumeral, est situé latéralement par rapport au macrochète présutural.
Sommaire
- 1 Caractères morphologiques de la larve
- 2 Biologie des Sarcophagidae
- 3 Classification
- 4 Notes et références
- 5 Liens externes
Caractères morphologiques de la larve
Pour la connaissance des caractères morphologiques et taxonomiques des imagos de ces sous-familles de diptères, ayant une particulière importance tant dans le maintien de l’équilibre biologique de la nature, que dans l’économie agricole et la vie médicale des hommes et des animaux, on peut trouver toutes les informations nécessaires dans la monographie sur les Sarcophaginae de l’Afrique[1]. Ainsi, seuls sont présentés les caractères morphologiques de la larve et la biologie des Sarcophaginae.
Le développement larvaire des diptères de la famille Sarcophagidae et, surtout, de la sous-famille Sarcophaginae a une grande importance biologique et applicative. Il se réalise sur de nombreux substrats nutritifs, ce qui confère aux espèces certains caractéristiques biologiques qui peuvent interférer dans la vie de l’homme et des animaux domestiques à grande valeur économique. Mais la plupart d'entre elles sont saprophages, en s’impliquant dans la transformation de la matière organique de la nature, et une partie d’elles sont spécialisées plus ou moins comme des parasites et vecteurs des agents pathogènes.
En général, les larves sont polyphages, en se développant sur les substances d’origine animale et végétale en décomposition, dans les excréments animaux et humains, dans les cadavres de différents animaux vertébrés et invertébrés. Dans le cas des espèces parasites, les larves se développent sur de nombreux hôtes parasites, y compris l’homme.
Le manque des substances animales détermine le développement larvaire d’un grand nombre de Calliphoridae et Sarcophagidae sur les matières fécales. Ces espèces coprophages, comme celles créophages (qui ont l'habitude de se nourrir de chair[2]) ou nécrophages, activant la décomposition des matières organiques, jouent un rôle très important dans l’assèchement du milieu ambiant, les odeurs fétides de fermentation ou putréfaction attirent les femelles et stimulent leur ovi- ou larviposition. Ainsi, certaines espèces, étant attirées par les abris des animaux malades ou par les nids des oiseaux et petits morts en différents états de décomposition, déposent leur ponte sur ceux-ci et leurs larves deviennent zoophiles. Par la suite, il paraît une ornithophilie occasionnelle.
Les larves de la sous-famille Sarcophaginae sont très semblables à celles de la famille des Calliphoridae, mais elles présentent des caractères différentiels bien précis. Dans le troisième stade de croissance, la larve (fig. 1) est acéphale, apode et amphipneustique[3]. Son corps est plus ou moins lisse, de forme conique, aigu à la partie antérieure, large et troqué à sa partie postérieure, sans processus dermal ni tubercule proéminent sur les surfaces dorsale et ventrale de tous les segments somatiques (exceptant le dernier segment). Il est divisé en 12 segments, dont le premier est le segment céphalique (sc) non sclérifié, les trois suivants sont les segments thoraciques (st), après lesquels suivent huit segments abdominaux (sa).
Les larves des stades II et III ont le corps plus ou moins couvert de spinules (petites épines) qui, d’habitude, forment une bande antérieure et une postérieure sur chaque segment somatique (fig. 2, A, C). Les spinules de la bande antérieure projettent en direction postérieure et ceux de la bande postérieure en direction antérieure. Le nombre des rangs de spinules des bandes semble avoir une certaine spécificité.
Par exemple, la larve de Bercaea cruentata a encore un rang de tubercules, qui entourent le milieu des segments 2-10, tandis que les larves de Curranea tibialis ont ces tubercules seulement sur le milieu des segments 9-10 et celles de Liosarcophaga babiyari sur les segments 7-10.
La densité même des spinules au mm2 est variable. D’après les recherches de B. R. Aspoas (1991), Bercaea cruentata en a 63+1/mm2, Liosarcophaga babiyari en a 42+1/mm2, Curranea tibialis en a 20+1/mm2 et Engelisca nodosa 15+1/mm2. Le premier segment thoracique porte une paire de stigmates antérieurs (sa) et le dernier segment abdominal garde une paire de stigmates postérieure sur le fond d’une cavité profonde, de forme circulaire ou ovoïdale. Ce dernier caractère est un des plus importants pour la reconnaissance de l’appartenance de la larve à la famille Sarcophagidae.
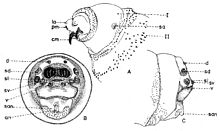
Explication de la fig. 1. sa, segments abdominaux; sc, segment céphalique; st, segments thoraciques; sta, stigmate antérieur; t, tubercules
Explication de la fig. 2. A: segment céphalique; B, le dernier segment abdominal, vu frontalement; C, le dernier segment abdominal, vu de profil; an, tubercules anaux; cm, crochets mandibulaires; d, tubercules dorsaux; la, lobes antennaux; pm, palpes maxillaires; sa, stigmate respiratoire antérieur; san, tubercules subanaux; sd, tubercules subdorsaux; sl, tubercules surlatéraux; sv, tubercules subventraux; v, tubercules ventraux; I, segment I thoracique; II, segment II thoracique. (selon Lehrer & Fromunda, 1986)Explication de la fig. 3. a, mandibule; b, crochet mandibulaire; c, pièce basale de la mandibule; d, angle antéro-ventrale de la mandibule; e, processus postéro-dorsal de la mandibule; f, sclérite dental; g, sclérite labial; h, sclérite subhypostomal; i, sclérite hypostomal; j, sclérite pharyngeal; k, processus antéro-dorsal du squelette pharyngeal; l, sclérite parastomal; m, arc dorsal; n, pièce basale du squelette pharyngeal; o, aile ventrale ou lame inférieure du squelette pharyngeal; p, fenêtre ventrale; r, sinus pharyngeal; s, aile dorsale ou lame supérieure du squelette pharyngeal; t, scissure dorsale de l’aile dorsale (selon Lehrer, 2006).
Le squelette céphalo-pharyngeal garde aussi très bien le caractère de la famille et, parfois, du genre.En général, le squelette céphalo-pharyngeal de la larve de stade III (fig. 3), qui présente les plus nombreux sclérites larvaires, est semblable à celui de la famille Calliphoridae. Il est formé d’une paire de mandibules (a), une pièce intermédiaire (i) et un grand squelette pharyngeal (j).
La mandibule a une pièce basale (c) plus ou moins rectangulaire, pourvue d’un processus postéro-dorsal (e) un angle antéro-ventral (d) et un crochet mandibulaire fort (b), qui serve comme moyen de dilacération du substrat nutritif et comme moyen de fixation et soutien dans les contractions somatiques pendant sa locomotion. Sous la pièce basale mandibulaire se trouvent le sclérite dentale (f) et deux petits sclérites: labial (g) et subhypostomal (h).
La pièce intermédiaire est représentée par le sclérite hypostomal (i) qui s’articule avec les mandibules et le sclérite pharyngeal (j). Ce dernier a un arc dorsal (m) dans sa partie antérieure, prolongé avec un processus antéro-dorsal (k) et un processus parastomal (l). Le sclérite pharyngeal a deux lames supérieures ou ailes dorsales (s), profondément incisées (t) et deux lames inférieures ou ailes ventrales (o), plus ou moins fenêtrées (p) à leur but terminal.
L’incision profonde des ailes dorsales (t) du squelette cephalo-pharyngeal est la caractéristique des larves de stade III des Sarcophagidae.
Explication de la fig. 4. A, extrémité céphalique de la larve, vu de profil; B, squelette céphalo-pharyngeal, vu de profil; C, crochets mandibulaires, vu de face; D, stigmates respiratoires postérieurs; ad, aile dorsale; at, atrium; av, aile ventrale; cm, crochets mandibulaires; f, sinus pharyngeal; la, lobes antennaux; m, mandibule; mm, bourgeons mandibulaires; p, papilles respiratoires; pad, processus antéro-dorsal; pbf, pièce basale pharyngeale; pbm, pièce basale mandibulaire; pm, palpes maxillaires; sf, sclérite pharyngeal; sh, sclérite hypostomal (selon Lehrer & Fromunda, 1986)
Aux sous-familles primitives (Miltogrammatinae, Paramacronychiinae), les larves de stade I sont caractérisées seulement par une seule mandibule, qui a l’aspect d’un crochet médian fonctionnel grand et une paire de maxilles sous la forme de pièces latérales plus ou moins développées. Ainsi, espèce Wohlfahrtia magnifica Schiner, étant un parasite sarcophage, possède une paire de maxilles très fortes (fig. 4, B, m), tandis que Wohlfahrtia meigeni Schiner, qui est un saprophyte, a un squelette céphalo-pharyngeal moins sclérifié, pourvus de deux maxilles minces, allongées, très peu sclérifiées et pigmentées.Les stigmates antérieurs, localises sur les parties latérales du premier segment thoracique, sont formés d’un nombre de papilles, pourvues d’orifices apicaux, qui communiquent dans une chambre basale et, à l’extérieur, sont disposées en demi-cercle, sur un ou plusieurs rangs. Le nombre des papilles varie chez les individus de la même espèce, mais seulement dans certaines limites, celui-ci caractérisant aussi espèce. Ainsi, la larve de stade III de Bercaea cruentata Meigen a 11-13 papilles disposées sur un seul rang; celle de Curranea tibialis Macquart a 15-21 papilles arrangées sur deux rangs irréguliers; celle de Parabellieria melanura Meigen a 16-22 papilles sur un rang; celle de Parasarcophaga albiceps Meigen a 32-38 papilles arrangées sur rangs irréguliers; celle de l'espèce japonaise Liosarcophaga shiritakaensis Ho a 46-49 papilles; celle de Robineauella scoparia Pandellé 48-54 papilles sur quelques rangs irréguliers, etc. Les stigmates postérieurs ont la même structure comme les larves de Calliphoridae. Ils ont une forme subronde, entourée par un anneau péritremal incomplet, dépourvu du bouton et pourvu de trois fentes respiratoires. Près de la marge dorsale des fentes respiratoires se trouvent les poils spiraculaires.
Chaque poil a un tronc qui se ramifie en formes différentes, caractéristiques pour chaque espèce. Ils ont été mis en évidence avec l’aide de scanning-electron-microscopie (Jirou, 1986; Aspoas, 1991).
Autour de la cavité postérieure du dernier segment abdominal se trouve 6 paires de tubercules: dorsaux, subdorsaux, supéro-latéraux, inféro-latéraux, subventraux et ventraux, et à la marge inférieure du même segment il y a les tubercules anaux et subanaux.
Biologie des Sarcophagidae
Les Sarcophagidés sont larvipares ou ovilarvipares, c’est-à-dire ils déposent larves ou œufs dont, immédiatement, éclosent les larves. Ce fait montre que les larves passent un certain temps dans l’organisme maternel, constituant ce qui s’appelle le parasitisme stationnaire. Un cas particulier est représenté par le genre Helicobosca (ou Eurychaeta) dont le développement larvaire a lieu dans l’abdomen maternel jusqu’au deuxième âge ou même quand il est nécessaire la nymphose.
Endoparasites des Lépidoptères
On sait maintenant avec certitude que les Sarcophagidés parasitent un nombre plus ou moins grand d'espèces de papillons. La difficulté de l’identification de ces diptères fait que ce phénomène est complètement ignoré. Autrefois, de la culture de Porthetris dispar L de Roumanie ont été obtenues Liosarcophaga portschinskyi Rohdendorf et des élevages du même hôte de Sardaigne, dans les années 1972-1977, ont été identifiées quelques espèces, parmi lesquelles: Liosarcophaga exuberans (Pandellé), Liosarcophaga tuberosa (Pandellé), Varirosellea uliginosa (Kramer), Liosarcophaga portschinskyi Rohdendorf, Curranea tibialis (Macquart), Sarcotachinella affinis (Fallen) et Thyrsocnema corsicana (Villeneuve). Excepté Sarcotachinella affinis (Fallen), qui est connue comme parasite de plusieurs hôtes de Geometrides, Lymantriides, Hyponomeutides et Lasiocampides, les autres espèces ont été mentionnées pour la première fois comme entomophage (Lehrer & Luciano, 1980).
Quelques espèces sont polyphages, ayant plusieurs hôtes. Ainsi, pour l’espèce nord-américaine Sarcodexia sternodontis Townsend on mentionne presque trente espèces de papillons.
Endoparasites des Orthoptères
Certains Sarcophagides parasitent les Orthoptères même au moment de leur éclosion. Les genres Blaesoxipha Loew, Sarcophila Rondani etc. attaquent les Grylides et d’autres genres d’Acridides, qui les poursuivent en vol sur une distance de plusieurs kilomètres.
Ils peuvent être univoltins ou polyvoltins, d’après le nombre des générations qui se succèdent dans un an. Blaesoxiphella brevicornis Villeneuve a trois générations par an et Acridophaga caridei (Brethes) 7-8 générations par an. La durée de chaque génération varie entre 1 et 2 mois. Chez Blaesoxipha krameri Baranov, la durée d’une génération est d’un mois, chez Acridophaga caridei (Brethes) elle est de 32-64 jours et davantage chez quelques espèces américaines.
L’accouplement peut avoir lieu 24 heures après l'éclosion de l’imago ou 8-12 jours après la maturité sexuelle et peut durer de 15 minutes (Blaesoxipha filipjevi Rohdendorf) jusqu’à 2 heures [(Blaesoxipha laticornis (Meigen)] ou plus.
Les femelles peuvent éjecter 1 à 5 larves en une fois et cela de 1 à 6 fois par jour, jusqu’à un total de 180 à 400 larves.
Les femelles de Blaesoxipha filipjevi Rohdendorf, Blaesoxipha unicolor (Villeneuve) ou Acridophaga caridei (Brethes) poursuivent les Acridiens du sol, tandis que Blaesoxipha krameri Baranov ceux pendant le vol. Les deux premières espèces prjettent les larves à distance sur leurs hôtes ; la dernière les dépose sur leur corps.
Dans le cas des espèces avec ovipositeur, les femelles habituent les hôtes à leur présence, par manœuvres de rapprochement, puis déposent les pattes sur eux et introduisent brusquement une ou plusieurs larves dans une région déterminée du corp: Blaesoxipha laticornis (Meigen) et Blaesoxipha berolinensis Villeneuve dans la cavité génito-anal; Blaesoxipha ungulata (Pandellé) dans la cavité buccal; Blaesoxiphella brevicornis Villeneuve et Servaisia rossica (Villeneuve) dans les plis intersegmentaux des tergites abdominau; Protodexia hunteri (Hough) à la base des pattes; Servaisia falciformis (Aldrich) inocule les larves par la cuticule des metafémurs de l'hôte.
Dans les hôtes les larves sont plasmophages, mais à la fin de la période du développement elles deviennent sarcophages et représentent un véritable péril pour l’orthoptère parasité. La durée de la vie dans l’intérieur de l'hôte varie entre 5-10 jours, et la métamorphose entre 1-4 semaines.
Parasites des arachnides
En 1986, Cantrell a observe dans l’Est de l’Australie les Sarcophagidae des genres Parasarcophaga (s. lat.) et Baranovisca Lopes qui parasitent les cocons des arachnides.
Endoparasites des vers de terre
En 1947 James considère que Sarcophaga carnaria Boettcher est un élément habituel des myiases sur certains pâturages de l’Europe, comme en Angleterre, Italie et Sicile, où elle produit la myiase des plaies chez les moutons.
Portschinsky a exprimé l’opinion que ces cas de myiases ne sont pas déterminés par Sarcophaga carnaria Boettcher, mais par Wohlfahrtia magnifica (Schiner). Kirchberg, en 1954 a affirmé que la première espèce est aussi un parasite obligatoire des vers de terre.
Myiasigènes
Les diptères de cette famille ont tendance à déposer leurs larves sur les plaies préexistantes ou sur les muqueuses intactes de plusieurs espèces d’animaux homéothermes, y compris l’homme, provoquant des disturbations fonctionnelles et, parfois, même leur mort. Néanmoins, seulement certaines espèces du genre Wohlfahrtia Brauer & Bergenstamm sont des parasites obligatoires et producteurs de myiases, les autres étant des myiasigènes facultatifs ou secondaires, mais presque aussi dangereux.
Dans la catégorie des myiasigènes obligatoires, Wohlfahrtia magnifica (Schiner) qui provoque la parasitose connue sous le nom de wohlfahrtiose, est répandue dans la région paléarctique, W. virgil (Walker) dans la région néarctique et W. nuba (Wiedemann) dans les régions paléarctique et éthiopienne.
Wohlfahrtia magnifica attaque les moutons, les vaches, les chevaux, les chiens et d'autres animaux homéothermes, en déposant ses paquets successifs d'œufs et de larves en très grand nombre, sur les tissus humides ou les plaies de ceux-ci. Les larves s'enfoncent rapidement et profondément dans les tissus et, en quelques jours elles provoquent des lésions énormes, qui peuvent déterminer la mort des hôtes. Parfois, les hommes de garde des troupeaux d'animaux, qui ont des plaies infestées et pas traitées ou qui dorment à l'air libre, peuvent être infestés par ce sarcophage.
Pendant les recherches faites en Roumanie sur cette "wohlfahrtiose" (A. Lehrer & Fromunda, 1986; A. Lehrer, M. Lehrer & Verstraeten, 1988; A. Lehrer & Verstraeten, 1991), ont été observées des nombreuses myiases graves et très graves chez les moutons de race Mérinos ou Corrideli, importées d'Australie ou Nouvelle-Zélande, qui correspondent à certaines conditions d'élevage.
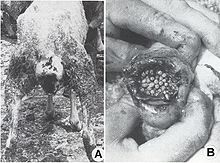
Après un court intervalle suivant leur importation, le parasite s'est multiplié vertigineusement et s'est répandu dans toutes les régions du pays, décimant 80-90% de l'effectif des moutons. La dispersion foudroyante du parasite est devenue un problème européen, parce que beaucoup de pays, qui ont voulu développer un secteur de moutons à laine fine et demi-fine, ont souffrit des préjudices économiques incalculables, surtout à la suite des myiases génitales : vulvaires (fig. 5 A) et du prépuce (fig. 5, B), des podomyiases (fig. 6, A) ou d’ophtalmomyiases (fig. 6, B), ainsi que des attaques mortelles des nouveau-nés.
De la catégorie des parasites facultatifs est identifié, plus ou moins correctement, un nombre de vingt-trois espèces, qui produisent notamment la myiase des plaies et des cavités naturelles, mais aussi celle intestinale des animaux et de l’homme. Ainsi, ont été mentionnées :
- Bercaea cruentata (Meigen) qui, ayant les larves coprophages très mobiles, peut provoquer tant la myiase rectale, que celle intestinale. Zumpt soutienne que les femelles déposent les larves pendant la défécation de l’homme et elles pénètrent rapidement dans le rectum par l’anus, pouvant compléter leur développement larvaire dans les intestins. Cette espèce produit aussi la myiase des plaies en Tripoli et dans l’île Maritaux.
- Boettcherisca peregrina (Robineau-Desvoidy) - infeste les plaies, étant accusée aussi de la myiase intestinale de l’homme dans l’Extrêmes Orient et les régions orientale et australienne.
- Ctenodasypygia fertoni Villeneuve - peut infester les plaies dans la région paléarctique.
- Curranea tibialis Macquart - a provoqué l’invasion des lésions de la tête, déterminées par Trichophytosis en Tripoli et, occasionnellement, la myiase intestinale de l’homme en Europe.
- Engelisca nodosa Engel - est accusée de myiase auriculaire et des plaies chez l’homme en Rhodésie.
- Jantia crassipalpis Macquart - est répandue dans les régions holarctique et australienne, étant mentionnée comme parasite secondaire des plaies aux moutons, en Serbie.
- Kellymyia plinthopyga Wiedemann - est mentionnée comme infestant les lapins et autres animaux en Guinée Britannique et Texas.
- Liopygia ruficornis Fabricius - produite la myiase cutanée en Inde aux l’homme, chiens, chevaux et bardeaux.
- Liosarcophaga babiyari Lehrer - les données parasitologiques de cette espèce ne sont pas sûres.
- Liosarcophaga ?misera Walker - Alwar & Seshian (1958) accuse cette espèce des myiases des plaies aux chameaux, bœufs et une vache de Madra. Mais, ces données ne sont pas sures parce que l’identification de l’espèce n’est pas correcte.
- Liosarcophaga tuberosa Pandellé - étant dans le groupe général “misera”, il n’y a aucune sûreté dans l’affirmation qu’elle provoque la myiase cutanée aux moutons.
- Parasarcophaga albiceps Meigen - mentionnée qu’elle a déterminé la myiase cutanée chez un taureau en Inde (Senior-White, Aubertin & Smart).
- Parasarcophaga hirtipes Wiedemann - très répandue en Extrême Orient et dans la région orientale, étant connue comme producteur de la myiase intestinale chez l’homme en Égypte. Elle détermine la myiase des plaies aux bétails et moutons en Rhodésie.
- Ravinia striata Fabricius - incriminée dans la myiase intestinale par Castellani & Chalmers (1919), mais par Trofimov, Tsuav & Alieva (1958) aussi en Russie.
- Sapromyia bullata Parker - accusée des myiases des plaies et intestinale chez l’homme dans les états du sud de la région néarctique.
- Sarcodexia sternodontis Townsend - provoque la myiase des plaies aux hommes et aux animaux dans le sud de l’Amérique, aux bétails en Floride et la myiase auriculaire dans la zone du canal du Panama.
- Sarcophaga carnaria Boettcher - les données sur son statut de myiasigène ne sont pas sûres, parce qu’elle est considérée comme parasite obligatoire des vers de terre (Kirchberg, 1954).
- Thomsonea argyrostoma Robineau-Desvoidy - infeste les plaies de l’homme et des animaux en Serbie, en association avec Wohlfahrtia magnifica Schiner.
- Titanogrypa pedunculata Aldrich - détermine la myiase auriculaire et celle des tissus nécrosés de l’homme dans la région du canal de Panama.
- Tricholioproctia froggati Taylor - parasite secondaire des moutons en Australie tropicale et subtropicale.
Classification
La taxonomie de cette famille constitue un foyer de discussions et disputes, parfois très passionnés, entre les chercheurs ayant des conceptions conservatoires et ceux qui utilisent des moyens de recherche plus modernes.
Liste des genres
- sous-famille Miltogramminae
- genre Metopia
- genre Miltogramma
- genre Pterella
- genre Sphenometopa
- genre Taxigramma
- sous-famille Paramacronychiinae
- genre Brachicoma
- genre Goniophyto
- genre Nyctia
- genre Sarcophila
- genre Wohlfahrtia
- sous-famille Sarcophaginae
- genre Argoravinia
- genre Blaesoxipha
- genre Boettcheria
- genre Chlorosarcophaga
- genre Dexosarcophaga
- genre Duckemyia
- genre Engelimyia
- genre Fletcherimyia
- genre Helicobia
- genre Metoposarcophaga
- genre Notochaeta
- genre Oxysarcodexia
- genre Peckia
- genre Peckiamyia
- genre Ravinia
- genre Sarcodexia
- genre Sarcofahrtiopsis
- genre Sarconesia
- genre Sarcophaga
- genre Sinopiella
- genre Spirobolomyia
- genre Titanogrypa
- genre Tricharaea
- genre Villegasia
- genre Tephromyiopsis
- genre Udamopyga
- sous-famille Miltogramminae
- sous-famille Sarcophaginae
Taxonomie et classification d'après la morphologie des organes mâles
Acceptant que cette famille se partage en trois sous-familles (Miltogramminae, Paramacronychiinae et Sarcophaginae), bien que certaines intuitions taxonomiques prédéterminent encore d’autres groupes importants.
La plus importante sous-famille est Sarcophaginae, qui comprend un très grand nombre de taxons génériques et spécifiques et qui connaît un développement intéressant d’un seul genre initial Sarcophaga Meigen, 1824. Après une période d’accumulation initiale de données, plus ou moins sommaires et très généralisées, les études de G. Böttcher (1912-1913) ont constitué un moment crucial pour la taxonomie de la famille. Observant la grande convergence des caractères somatiques, il a abordé sous une manière scientifique, l’étude des genitalia mâles des espèces et a prouvé que leurs complexité et configuration sont les éléments les plus sûrs pour l’identification des taxons, de rang différent.
 Fig. 7. Boris Borisovitsch Rohdendorf
Fig. 7. Boris Borisovitsch Rohdendorf
Boris B. von Rohdendorf (1937) est une des figures emblématiques de l'étude de la taxonomie moderne des Sarcophagides. Il montre que les esquisses des génitalia mâles présentées par Böttcher sont trop schématiques et que, par méthodes histologiques et graphiques plus évoluées, on peut découvrir de nombreux taxons inconnus. Par cette conception, il fixe les bases scientifiques du système d'étude taxonomique de la sous-famille Sarcophaginae, tant pour la région paléarctique, que pour celle éthiopienne (1963). Sa méthodologie a été suivie par un nombre important de chercheurs: Baranov, Cepelak, Lehrer, Povolny, Fan Zide, Lopes, Kano, Shinonaga, Mihalyi, Verves etc. Ils considèrent que le type de structure des génitalia mâles et, notamment, du phallosome, reflète mieux la valeur hiérarchique des unités taxonomiques fondamentales de genre et d’espèce, due à sa grande stabilité génétique. Cette vision s'oppose fermement à celle d'un autre diptérologiste français, Eugène Séguy (1941), qui a adopté l’unité générique Sarcophaga.
Après soixante ans, Thomas Pape (1996) relance l'ancien système de Böttcher (adopté aussi par Séguy) et élabore un système de phylogénétique chez les Sarcophagidae, sur la base de certaines analyses cladistiques. Il supprime la sous-famille Sarcophaginae sensu Rohdendorf & Auctoribus, en invoquant l'existence de nombreux groupes « monophylétiques » dans cette sous-famille. Ses opposants répondent que du point de vue taxonomique, en conformité avec les normes du Code International de Nomenclature Zoologique[6], chaque taxon, sans tenir compte de son rang, doit être « monophylétique », ou mieux dire « monotypique » et non « polyphylétique » ou « politypique ». Car, dans ce dernier cas, on ne peut garder un ordre systématique scientifique ou « naturel ».
Sous cette forme « phylogénétique », Pape a rétrogradé les genres de Sarcophagidae, établis dans les huit dernières décennies par les diptérologistes, en les considérant comme « sous-genres » ou « épithètes intercalées », sans valeur taxonomique et rejetables.Caractères morpho-taxonomiques des imagos
Pour la connaissance des Sarcophagidae certaisn étuduent donc leurs caractères morpho-taxonomiques. Ceux-ci peut donner non seulement la base de la compréhension des traits bio-écologiques générale de cette famille, mais aussi la possibilité de pénétrer dans la spécificité de ces éléments constitutifs.
Ces caractères permettraient également l’élaboration d’un instrument d’appréciation des limites de variabilité, qui coexistent dans les catégories taxonomiques fondamentales, dans une forme adéquate, scientifique et de niveau international.
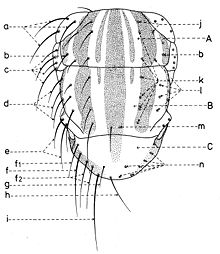
Chétotaxie de la tête
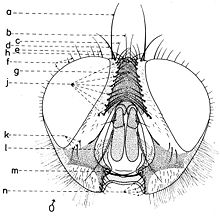
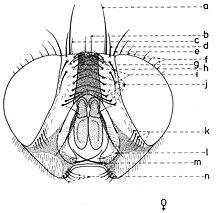
En général, les macrochètes portent les noms des parties dans lesquelles ils sont implantés. Ils forment, d’habitude, une garniture complète aux femelles (fig. 10). Chez les mâles (fig. 9) certains d’eux peuvent manquer (les macrochètes parafrontaux ou orbitaux), ou ils sont très peu développés (les macrochètes verticaux externes).
Sur le vertex, les plus forts sont les macrochètes verticaux internes (a), auprès des macrochètes verticaux externes (c), beaucoup plus petits ou qui manquent. Sur le triangle ocellaire, entre l’ocelle antérieur et ceux postérieurs sont les macrochètes ocellaires (h), plus petits, proclines et divergents, ayant parfois de dimensions très réduites. De chaque côté de la bande frontale médiane il y a 5-14 paires de macrochètes frontaux proclines (j), qui descendent du triangle ocellaire jusqu’au niveau du deuxième article de l’antenne, mais qui augmentent en grandeur et épaisseur. Même la bande frontale médiane a parfois quelques paires de macrochètes intrafrontaux (g), spécialement sur sa moitié postérieure.
Avant les macrochètes verticaux externes s’observe un macrochète prévertical (d) fort et rétrocline. Au femelles, sur les parafrontalies, à la proximité de la marge des yeux, il y a une paire de macrochètes parafrontaux (i) ou orbitaux bien développés et proclines. Sur les parafacialies et près de la marge antéro-inférieure des yeux on observe un rang vertical plus ou moins grand de macrochètes parafaciaux (k) ou gènes, dont ceux inférieurs sont souvent plus longs et plus gros que les autres. Au sommet de l’angle antéro-inférieure du péristome, connu sous le nom de vibrissarium, il existe un macrochète très développé qui s’appelle la grande vibrisse (m) et qui se croise avec sa symétrique avant la cavité buccale. Au-dessus d’elles, quelques petites vibrisses (l) montent plus ou moins sur les bordures faciales, jusqu’à un niveau caractéristique pour l’espèce. Sur les marges latérales de la cavité buccale se trouve un rang de macrochètes péristomaux (n), moins utilisés dans la taxonomie des Sarcophagides. Le péristome est couvert de poils noirs, mais parfois de poils blancs ou blancs jaunâtre aussi, qui descendent de la région postérieure de la tête.
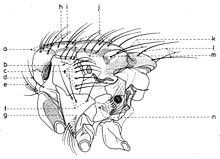
Sur chaque côté de l’occiput (fig. ), à la hauteur des macrochètes verticaux (h, m) et ocellaires (f) se trouve un ou plusieurs macrochètes postverticaux (l) et postocellaires (k) piliformes. À la marge postérieure de la bordure postoculaire il y a un rang de macrochètes postoculaires (i) proclines de dimensions réduites et, plus bas, 2-3 rangs de microchètes occipitaux (j), disposés sur la moitié supérieure de la région postérieure.
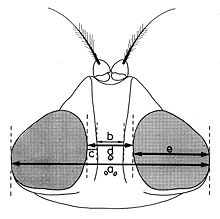
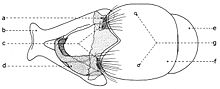
Biométrie de la tête
Dans la taxonomie des Sarcophagides, comme dans celle d’un grand nombre de diptères, certains indices biométriques ont une importance assez grande. Les facteurs suivants sont pris en considération :
a - Les indices établis quand la tête est examinée du dessus (fig. 11):
- largeur de la tête (a);
- largeur d’un œil (e);
- largeur du front (d), mesurée au lieu le plus étroit;
- largeur de la bande frontale médiane (b), mesurée au même niveau;
- largeur d’une parafrontalie (c), mesurée au même lieu.
b - Indices déterminés quand la tête est examinée de profil (fig. 12):
- hauteur de la tête (a);
- grand diamètre oculaire (b);
- petit diamètre oculaire (c);
- hauteur du péristome (d);
- proéminence frontale ou profrons (e);
- rapport entre la longueur du troisième article de l’antenne (f) et celle du deuxième article (g).
Chétotaxie du thorax
Avec peu d’exceptions, les macrochètes du thorax portent aussi les noms des lieux ou ils sont fixés. Sur sa partie dorsale (fig. 13) s’observent quelques rangs et groupes de:
- macrochètes achrosticales (m). Souvent ils peuvent être limités seulement à une paire préscutelaire; sur la partie antérieure du mesonotum peuvent exister encore quelques paires courtes, qui dépassent un peu la pilosité fondamentale du tegumentum.
- macrochètes dorso-centraux (k) présuturaux au nombre de 3-4 et postsuturaux au nombre de 3-5 paires. Les derniers ont une grande importance dans la taxonomie du groupe.
- macrochètes intraalaires (l). Celui présutural (b) peut manquer, et les autres sont au nombre variable.
- macrochètes huméraux (a) sur le callus humeral.
- macrochètes posthumeraux (j).
- macrochète présutural (b). À la famille Sarcophagidae, de règle, il se trouve plus bas et plus vers l’extérieur devant le dernier macrochète posthumeral. Parfois il peut manquer.
- macrochètes supraalaire (d), situés après la suture et au-dessus de l’aile.
- macrochètes notopleuraux (c) sur les notopleures.
- macrochètes postalaires (e) sur les callus postalar.
- macrochètes scutellaires (n) qui se divisent en: macrochètes apicaux (h) - présents ou absents, petits, demi-érects, croisés, divergents etc.; macrochètes subapicaux (i) - très développés; les macrochètes latéraux - qui se catégorisent en: macrochètes latéraux proprement dit (f2) - au nombre de 1-3 ou peuvent manquer, macrochètes basaux (f) - forts et macrochètes prébasaux (f1); macrochètes discaux (g) - placés au-dessus du disque scutellaire et près de l’apex, plus fins et d’habitude demi-érects.
De profil (fig. 14), le thorax présent :
- macrochètes propleuraux (e), souvent entourés de quelques poils macrochètiformes supplémentaires.
- macrochètes prostigmaticaux (d), entourés aussi de 1-2 poils auxiliaires.
- macrochètes mésopleuraux (c).
- macrochètes sternopleuraux (f), situés souvent en ligne, dans la position 1:1:1; mais le médian peut manquer et alors leur position est 2:1 ou 3:1 (Agria Robineau-Desvoidy, Angiometopa Brauer & Bergenstamm).
- macrochètes infrasternopleuraux (g).
- macrochètes hypopleuraux (n).
Nervation
La disposition des nervures (longitudinales et transversales ou nervules) est semblable avec celle des autres familles des superfamilles Sarcophagidea et Tachinidea (fig. 15).
D’après le système de Comstock-Needham, les nervures longitudinales qui se trouvent chez les Sarcophagides, sont les suivantes:
- la nervure costale (c), qui confine la partie antérieure de l’aile jusqu’à l’apex. Elle a deux fractures dans sa partie proximale; à une d’elle se trouve l’épine costale sensorielle ou plectrum (l). Elle se dilate à la base, portion nommée costagium (4); et au point d’insertion de la nervure costale il y a deux sclérites sous la forme d’écailles: un proximal ou épaulette qui est une tegula et l’autre distal ou basicosta (5). Dans sa monographie sur les Sarcophagides paléarctiques, Verves fait toujours la confusion entre ces deux sclérites, en les inversant.
- la nervure subcostale (sc) est courte, concave et atteinte la nervure costale au niveau de l’épine costale.
Le système des nervures radiales est l’élément le plus fort de l’aile et se divise en :
- la nervure r1 ou la première nervure radiale (r1), convexe et prolongée jusqu’à l’extrémité de l’aile. Parfois elle est pourvue de macrochètes à la base ;
- la nervure r2+3 ou la deuxième et la troisième nervure radiale (r2+3) ;
- la nervure r4+5 ou la quatrième et la cinquième nervure radiale (r4+5), souvent pourvus de microchètes du nœud radial (2) et sur une distance plus longue ou plus courte vers la nervure transversale r-m (r-m).
Le système des nervures médiales (m), en connexion avec celui des nervures cubitales, s’unis aussi à la base avec les nervures radiales, par l’intermédiaire d’une nervure moins distincte, nommée arculus (9). Ainsi, elles sont dépendantes tant du tronc radial commun ou brachiolum (7), que du celui du quatrième sclérite axillaire (8). Elles se pressentent comme :
- la nervure médiale (m), qui se dirige vers l’extrémité de l’aile, où se courbe en haut et, puis, se courbe vers la marge antéro-apicale sous la forme de la nervure m1+2 ou la première et la deuxième nervure médiale (m1+2). Le point de courbure angulaire se nom cubitulus (11), celui-ci étant prolongé soit d’un pli, soit d’une nervure très courte nommée appendix.
- la nervure m3+4 ou la troisième et la quatrième nervure médiale (m3+4), qui se bifurque transversalement près de la base et, puis, se dirige vers la marge postérieure de l’aile, vers l’excision préanale.
Viennent aussi :
- la nervure cu1+an1 ou la première nervure cubitale et la première nervure anal (cu1+an1), qui marchent indépendamment sur une petite portion basale (cu1 et an1) et puis s’unissent.
- la nervure an2 ou la deuxième nervure anale (an2).
Les nervures transversales sont au nombre de 4, à savoir,
- la nervure transversale humérale (h), qui unie près de la base les nervures costale et subcostale.
- la nervure transversale radio-médiale (r-m), qui unie les nervures et m.
- la nervure transversale intermediale (m-m), qui unie les nervures m et m3+4.
- - la nervure transversale médio-cubitale (m-cu), qui unie à la base les nervures m3+4 et cu1.
Les cellules sont les espaces alaires délimitées par nervures et portent d’habitude les noms des nervures qui les confinent dans leur partie antérieure. Elles sont notées avec de lettres majeures et peuvent être fermées (quand elles sont délimitées apicalement par de nervures transversales ou l’espace cellulaire est entouré par deux nervures qui confluent. En cas contraire, elles sont ouvertes.
Chez les Sarcophagidae sont présentes les cellules suivantes:
- la cellule costale basale (1C);
- la cellule costale distale (2C);
- la cellule subcostale (Sc);
- la première cellule radiale ();
- la troisième cellule radiale (R3);
- la cinquième cellule radiale basale (1R5);
- la cinquième cellule radiale distale (2R5);
- la deuxième cellule médiale basale (1M2);
- la deuxième cellule médiale distale (2M2);
- la quatrième cellule médiale basale (1M4);
- la quatrième cellule médiale distale (2M4);
- la cellule cubitale (Cu);
- la première cellule anale (An1);
- la deuxième cellule anale (An2).
Abdomen des Sarcophagidae
Hormis les caractères chétotaxiques et chromatiques des Sarcophagidés, les plus importantes caractères taxonomiques sont ceux des structures morphologiques de l’abdomen et notamment du postabdomen. Pour les comprendre ont doit les examiner, sous la prisme des recherches modernes.
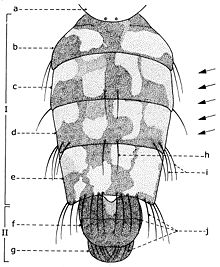 Fig. 16. Abdomen de Sarcophaga carnaria Böttcher, 1912, vu dorsalement. Explication de la fig. 16. Abdomen du mâle de Sarcophaga carnaria Böttcher: I: préabdomen; II: postabdomen; a: scutellum; b: segment I+II; c: segment III; d: segment IV e: segment V f: tergite génital; g: tergite anal; h: macrochètes médio-marginaux postérieurs; i: macrochètes marginaux postéro-latéraux; j: macrochètes marginaux postérieurs.
Fig. 16. Abdomen de Sarcophaga carnaria Böttcher, 1912, vu dorsalement. Explication de la fig. 16. Abdomen du mâle de Sarcophaga carnaria Böttcher: I: préabdomen; II: postabdomen; a: scutellum; b: segment I+II; c: segment III; d: segment IV e: segment V f: tergite génital; g: tergite anal; h: macrochètes médio-marginaux postérieurs; i: macrochètes marginaux postéro-latéraux; j: macrochètes marginaux postérieurs.
 Fig. 17. Abdomen de Sarcophaga carnaria Bottcher, vu ventralement. Explication de la fig. 17. Abdomen du male de Sarcophaga carnaria Bottcher, vu ventralement. a: tergite I+II; b: tergite III; c: tergite IV; d: tergite V; e: segment génital; f: segment anal; g: spiracle 1; h: spiracle 2; i: spiracle 3; j: spiracle 4; k: spiracle 5; l: chambre génitale; m: phallosome; n: postgonites; o: prégonites; p: paralobes; q: cerques; s1: sternite I; s2: sternite II; s3: sternite III; s4: sternite IV; s5: sternite V.
Fig. 17. Abdomen de Sarcophaga carnaria Bottcher, vu ventralement. Explication de la fig. 17. Abdomen du male de Sarcophaga carnaria Bottcher, vu ventralement. a: tergite I+II; b: tergite III; c: tergite IV; d: tergite V; e: segment génital; f: segment anal; g: spiracle 1; h: spiracle 2; i: spiracle 3; j: spiracle 4; k: spiracle 5; l: chambre génitale; m: phallosome; n: postgonites; o: prégonites; p: paralobes; q: cerques; s1: sternite I; s2: sternite II; s3: sternite III; s4: sternite IV; s5: sternite V.
Théoriquement, l'abdomen des Sarcophaginae est formé de 11 segments, dont 5 segments abdominaux visibles constituent le préabdomen (fig. 16, I; fig. 17, b-d) et les 6 segments réduits, atrophiés et transformes en aide des fonctions de reproduction, représentent le postabdomen (fig. 16, II; fig. 17, f-g).
Le préabdomène
Le préabdomen (fig. 16, I) est allongé-ovoidal ou svelte chez le mâle et plus large chez la femelle. Ses dessins dorsaux sont, le plus souvent, formés de taches changeantes de tomentum argenté, qui alternent avec de taches noires, donnant l'aspect en damier. Ces dessins, caractéristiques à la majorité des espèces de la sous-famille, sont variables, d'après l'incidence de la lumière. Mais, de plusieurs fois, ces taches sont disposées en bandes dorsales longitudinales sur tous les tergites préabdominaux. Autrefois, le préabdomen est cendré, avec taches plus ou moins circulaires et allongées sur tous les tergites ou seulement sur une partie de ceux-ci (l'espèce paléarctique Yerohama maculata Meigen, ou le genre éthiopienne Poecilometopa Villeneuve). Parfois, les bandes noires dorsales sont disposées transversalement et, très rarement, le préabdomen est complètement noir.
Aux mâles, les sternites III et IV (fig. 17, s3-s4) sont plus ou moins semblables au sternite II, bien qu'ils donnent l'impression qu'ils sont plus petits et plus étroits, tandis que chez les femelles, les sternites III-IV sont approximativement de la même forme. Le sternite V des mâles (fig. 10, s5) est hétéromorphe, ayant une pièce basale et deux lames latérales, qui peuvent former une fenêtre, souvent triangulaire et nommée fenestella. Chez beaucoup d'espèces, mais surtout chez celles néotropicales, il a des prolongements digitiformes ou d'autres apophyses simples et bifides. Sur la marge antérieure des lames latérales, comme sur leur surface inférieure, se trouvent un grand nombre de poils assez longs et, même, très longs vers leur apex. Beaucoup d'espèces ont de grandes agglomérations de macrochètes récurrents, courts et fournis sur les marges lamellaires intérieures, nommées brosses.
 Fig. 19. Postabdomen de Sarcophaga carnaria Böttcher, 1912, vu latéral. Explication de la fig. 19. Postabdomen male de Sarcophaga carnaria, vu de profil. a: spiracle 6; b: sternite V; c: hemitergites VI; d: sternite VI; e: tergite anal; f: tergite genital; g: spiracles 7; h: pregonites; i: postgonites; j: paralobes; k: cerques; l: organe copulateur;x: sternite X.
Fig. 19. Postabdomen de Sarcophaga carnaria Böttcher, 1912, vu latéral. Explication de la fig. 19. Postabdomen male de Sarcophaga carnaria, vu de profil. a: spiracle 6; b: sternite V; c: hemitergites VI; d: sternite VI; e: tergite anal; f: tergite genital; g: spiracles 7; h: pregonites; i: postgonites; j: paralobes; k: cerques; l: organe copulateur;x: sternite X.
Le postabdomen
Le postabdomen du mâle est connu sous le nom de terminalia mâle ou hypopigium (fig. 16, II; fig. 17, e-f; fig. 18, e-f; fig. 19, e-f). Après l'éclosion des imagos, le hypopigium soufre une rotation de 360 degrés par rapport à l'axe longitudinal de l'abdomen, entre les segments V et VI. Ainsi le canal éjaculateur se tourne autour de l'intestine postérieure, le postabdomen revenant apparemment dans sa position initiale normale. Ce type de hypopigium circumversum entraîne après lui diverses modifications et asymétries des certaines sclérites (par exemple, le sternite VI), la fusion ou la disparition des autres, avec conséquences profondes dans sa morphologie générale (la migration des segments et spiracles etc.).
Chez beaucoup de représentants de la sous-famille Sarcophaginae, le segment VI abdominal ou le premier segment postabdominal (fig. 18-19) a un tergite entier ou divisé en deux hemitergites (c) réduits et pas sclérifiés, identifiables (dans la plupart des cas) par deux groupes linéaires de macrochètes. Le sternite VI (d) est déformé, asymétrique, ayant développée seulement la partie gauche et il est soudé de la base des lobes latérales du sternite V (b). Dans la membrane pleurale sont visibles les spiracles de la paire VI (a). Cependant, aux autres genres et espèces, le tergite VI peut manquer complètement (Bercaea cruentata Meigen, Blaesoxipha krameri Baranov).
Après le tergite VI se succède un tergite bien développé, qui est considéré le syntergite VII+VIII (fig. 19, f), parce qu'il résulte de la fusion des tergites VII et VIII. La preuve est donné tant par l'existence d'une suture sur son milieu, que par la présence des spiracles de la paire VII (g) seulement dans la région correspondante au tergite VII, l'autre paire (la VIIIme) ne se trouve pas chez les imagos des diptères. Il est nommé aussi le tergite génital ou le premier tergite génital.
A une série d'espèces de Sarcophagides, le tergite VI est soudé avec le tergite VII+VIII, sa ligne de suture étant marquée visiblement (Agria affinis Fallen, Wohlfahrtia balassogloi Portschinsky). En échange, à une autre série, les tergites VI, VII et VIII sont plus ou moins individualisés (Mimodexia magnifica Rohdendorf).
Se succède le tergite du dernier segment, connu sous le nom de tergite anal (e), le deuxième tergite génital ou, le plus souvent, epandrium. Zumpt et Heinz (1949,1950) l'ont conçu comme « 10th segment and cerci ». Il est le tergite auquel se connecte, dans sa partie antéro-ventrale, l'organe copulateur mâle, avec tous les sclérites que lui desservent intimement et, dans la partie postérieure, ses appendices auxiliaires.
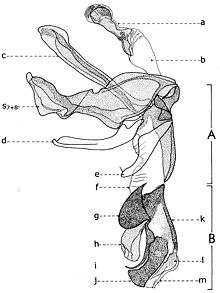
Explication de la fig. 20. Phallosome de Sarcophaga carnaria Bottcher., vu de profil. A: basiphallus; B: distiphallus; a: apodeme du canal ejaculateur; b: canal ejaculateur; c: phallapodema; d: pregonite; e: postgonite; f: membrana; g: lobes hypophalliques basaux; h: lobes membranaux; i: lobes hypophalliques ventraux; j: styles; k: paraphallus; l: branches laterales du paraphallus; m: juxta; S7+8: sternite VII+VIII.
A la base de l'organe copulateur se trouve un sclerite relativement grand (fig. 20, st7+8), qui l'entoure et a un aspect d'un auget. Il est connu dans littérature sous le nom de tergosternum IX ou hypandrium et défini, en général, comme le sternite IX (Tuxen, 1970). Mais Zumpt et Heinz croient que dans sa structure participent tant le tergite IX, que le sternite IX, d'où la dénomination prise de Patton et Cushing. Séguy (1941) n'a donné aucune attention à cette formation, indiquant erronément le sternite IX sous le nom de l'apodème du canal ejaculateur (a).Dans une interprétation actuelle, il n'est ni le « sternite IX » et ni le résultat de la fusion des tergite et sternite IX. Il est simplement le correspondent du tergite VII+VIII, ou mieux dire, le sclerite qui résulte de la fusion des sternites VII et VIII.
Tenant compte du postulat de Weber, d'après lequel l'orifice génital se trouve au bout postérieur du sternite IX, alors on peut constater que l'orifice génital n'est pas au bout du « tergosternum IX » ou hypandrium (sensu Emden et Hennig) - comme pensent encore les dipterologiste contemporains, mais au celui d'une apophyse sous la forme d'une baguette aplatisse, située dans l'intérieur du sternite VII+VIII et appréciée erronément par les auteurs comme une néoformation, la phallapodema ou l'apodème du pénis (c). Dans autres termes, comme s'est observé autrefois aussi aux Syrphidae (Lehrer, 1971), cette phallapodème est le véritable sternite IX.
D'un côté et d'un autre de l'organe copulateur (fig. 20) il y a une paire d'appendices plus ou moins sous la forme de crochètes : les prégonites ou les paramères antérieurs (d) et les postgonites ou les paramères postérieurs (e). Leur origine n'est pas bien clarifiée par les auteurs, la majorité acceptant qu'ils dérivent du sternite IX (sensu auct.). Zumpt et Heinz affirment, sans aucune preuve, qu'alors quand il existe deux paires de paramères (comme dans le cas des Sarcophagidae), ils proviennent de la division des lobes paramèraux. Mais, des recherches actuelles sur le postabdomen des Syrphidae résulté que les prégonites ont leur origine dans le sternite VIII (sternite IX sensu Emden & Hennig), tandis que les postgonites proviennent du sternite IX (phallapodema sensu Emden & Hennig).
Dans la partie postérieure du tergite X sont fixées deux paires d'appendices relativement longs: les paralobes (fig. 19, j) et les cerques (fig. 19,k). La première paire, désignées par divers auteurs sous le nom de mesocerques latéraux, forceps externes, gonopodes ou surstyli, descendent du sternite X et pas du tergite du segment IX (conf. Emden & Hennig et. Auct.). Chez toutes les espèces étudiées de la famille Syrphidae, les branches ou les prolongements postérieurs du sternite X sont soudes toujours avec ces paralobes.
Chez Sarcophaga carnaria Boettcher., le sternite X est très réduit, en se présentant comme des hemisternites (fig. 19, x), plus ou moins ovoïdaux, petits et situes dans la membrane d'entre les paralobes et la marge inférieure du tergite X. Pour être découvertes, il est nécessaire une forte détente de la membrane ou le relèvement des paralobes qui les couvrent. Le sternite X a été observé tout d'abord par Patton (1934), qui l'a considéré erronément comme le spiracle de la VIII-me paire et, puis, par Zumpt et Heinz, qui ont lui donné l'interprétation correcte.
En échange, les cerques sont les réminiscences du segment XI abdominal, duquel n'est pas resté que le proctiger ou la membrane qui s'étend dans l'émargination du tergite X, y compris seulement l'anus.
Les genres des Sarcophagidae selon les morphologistes
Les genres de cette famille sont très nombreux dans toutes les régions zoogéographiques. En même temps, ils ne sont pas assez bien connus et nous ne savons pas dans quelle proportion ils représentent une certaine région. C’est pourquoi, nous donnons une liste avec les genres les mieux représentés dans les régions paléarctique, afrotropicale et orientale.
- Aethianella Zumpt
- Aethiopisca Rohdendorf
- Afrohelicobia Zumpt
- Afrothyrsocnema Rohdendorf
- Agria Robineau-Desvoidy
- Agriella Villeneuve
- Aleximyia Rohdendorf
- Amharomyia Verves
- Amibia Robinea-Desvoidy
- Anacanthothecum Rohdendorf
- Angiometopa Brauer & Bergenstamm
- Annefrankia Lehrer
- Anthostilophalla Lehrer
- Apodacra Macquart
- Asceloctella Enderlein
- Asiometopia Rohdendorf
- Aspidophalla Rohdendorf
- Bantuphalla Lehrer
- Baranovisca Lopes
- Barnardia Lehrer
- Batissophalla Rohdendorf
- Bechuanella Lehrer
- Bercaea Robinea-Desvoidy
- Beziella Enderlein
- Bilenemyia Verves
- Blaesoxipha Loew
- Boettcherella Enderlein
- Boettcherisca Rohdendorf
- Brachicoma Rondani
- Brasia Strand
- Burmanomyia Fan
- Callostuckenbergia Lehrer & Lehrer
- Camerounisca Verves
- Ceratophalla Rohdendorf
- Cercosarcophaga Zumpt
- Chaetanicia Townsend
- Chaetophalla Rohdendorf
- Craticulina Bezzi
- Ctenodasypygia Enderlein
- Ctenodasypygia Enderlein
- Curranea Rohdendorf
- Curranisca Rohdendorf
- Curtophalla Lehrer
- Cyclophalla Rohdendorf
- Cylindrothecum Rohdendorf
- Danbeckia Lehrer
- Dasysceloctis Enderlein
- Deconinckia Lehrer
- Devriesia Lehrer
- Dinemomyia Chen
- Diplonophalla Lehrer
- Dolichotachina Villeneuve
- Dovporiella Lehrer
- Draculana Lehrer
- Durbanella Lehrer
- Engelisca Rohdendorf
- Eremasiomyia Rohdendorf
- Eumetopiella Hendel
- Fanzidella Lehrer
- Fengia Rohdendorf
- Golania Lehrer
- Goniophyto Townsend
- Grimaldiomyia Lehrer
- Hadashophalla Lehrer
- Harpagophalla Rohdendorf
- Harpagophalloides Rohdendorf
- Helicophagella Enderlein
- Heteronychia Brauer & Bergenstamm
- Hilarella Rondani
- Hoa Rohdendorf
- Hoplacephala Macquart
- Hoplocephalomima Verves
- Horia Kano, Field & Shinonaga
- Horisca Rohdendorf
- Hyperacanthisca Rohdendorf
- Ihosyia Verves
- Imerina Lehrer
- Iranihindia Rohdendorf
- Jaennickeana Lehrer
- Jantiella Rohdendorf
- Kanomyia Shinonaga & Tumrasvin
- Kramerea Rohdendorf
- Krombeinomyia Verves
- Leclercqiomyia Lehrer
- Leucomyia Brauer & Bergenstamm
- Liopygia Enderlein
- Liosarcophaga Enderlein
- Livingstonelia Lehrer
- Macabiella Lehrer
- Macronychia Rondani
- Malawithyyrsia Lehrer
- Malliophalla Lehrer
- Mandalania Lehrer
- Mauritiella Verves
- Mediterranisca Rohdendorf
- Mesomelaena Rondani
- Metopia Meigen
- Metopodia Brauer & Bergenstamm
- Miltogramma Meigen
- Miltogrammidium Rohdendorf
- Miltogrammoides Rohdendorf
- Mitumbana Lehrer
- Nepalisca Rohdendorf
- Nguyenia Lehrer
- Nuzzaciella Lehrer
- Nyctia Robineau-Desvoidy
- Nyikamyia Lehrer
- Oebalia Robineau-Desvoidy
- Pandelleana Rohdendorf
- Pandelleisca Rohdendorf
- Parabellieria Verves
- Parasarcophaga Johnston & Tiegs
- Petuniophalla Lehrer
- Phallocheira Rohdendorf
- Phallosphaera Rohdendorf
- Pharaonops Lehrer
- Phrosinella Robineau-Desvoidy
- Phylloteles Loew
- Pierretia Robineau-Desvoidy
- Prionophalla Rohdendorf
- Protomiltogramma Townsend
- Pterella Robineau-Desvoidy
- Pterolobomyia Lehrer
- Radamaia Lehrer
- Ravinia Robineau-Desvoidy
- Robertiana Lehrer
- Robineauella Enderlein
- Rohdendorfisca Grunin
- Roselles Rohdendorf
- Salemiophalla Lehrer
- Sarcophaga Meigen
- Sarcophila Rondani
- Sarcorohdendorfia Baranov
- Sarcosolomonia Baranov
- Sarcotachina Portschinsky
- Sarcotachinella Townsend
- Seniorwhitea Rohdendorf
- Senotainia Macquart
- Servaisia Robineau-Desvoidy
- Seselwana Lehrer
- Sinonipponia Rohdendorf
- Spatulapica Fan
- Sphenometopia Townsend
- Stuckenbergiella Verves
- Synorbitomyia Townsend
- Taxigramma Peris
- Thomsonea Rohdendorf
- Transvaalomyia Lehrer & Lehrer
- Tuberomembrana Fan
- Virungana Lehrer
- Wittemyia Lehrer
- Wohlfahrtia Brauer & Bergenstamm
- Wohlfahrtiodes Villeneuve
- Xanthopterisca Rohdendorf
- Yerohama Lehrer
- Zombanella Lehrer
- Zumptiopsis Lehrer & Lehrer
- Zumptisca Rohdendorf
Sources bibliographiques principales
- Baranov, N. (1925), Neue Dipteren aus Serbien. – Let. Pol. Odl. Kontr. Sta. Topcideru, Belgrad, 1:1-11.
- Baranov, N. (1941), Zweiter Beitrag zur Kenntnis der Gattung Sarcophaga (s.l.). Vet. Arh., 11:361-404 [In Croatian and German].
- Becker, T. (1908), Dipteren der Kanarischen Inseln. Mitt. zool. Mus. Berlin, 4:1-180.
- Böttcher, G. (1912), Die männlichen Begattungswerkzeuge der Arten bei dem Genus Sarcophaga Meigen. und ihre Bedeutung für die Abgrenzung der Arten. Dtsch. ent. Z., 525-544, 705-736.
- Bôttcher, G. (1913), Die männlichen Begattungswerkzeuge der Arten bei dem Genus Sarcophaga Meigen. und ihre Bedeutung für die Abgrenzung der Arten. Dtsch. ent. Z., 1-16, 115-130, 239-254, 351-377.
- Brauer, F. & Bergenstamm, J.E., (1889), Die Zweiflügler des Keiserlichen zu Wien. IV. Vorarbeiten zu einer Monographie der Muscaria Schizometopa (exclusive Anthomyidae). Pars I. Denkschr. Akad. Wiss., Wien, 56:69-180.
- Brauer, F. & Bergenstamm, J.E., (1891), Die Zweiflügler des Keiserlichen zu Wien. V. Vorarbeiten zu einer Monographie der Muscaria Schizometopa (exclusive Anthomyidae). Pars II. Denkschr. Akad. Wiss., Wien, 58:39-446.
- Enderlein, G. (1928a), Klassification der Sarcophagiden. Sarcophagiden-Studien I. Arch. klassifik. phylogen. Ent., 1:1-56.
- Enderlein, G. (1928b), Sarcophgiden-Studien II. Konowia, 7:147-153.
- Enderlein, G. (1936), 22. Ordnung: Zweiflügler, Diptera. Die Tierwelt Mitteleuropas. Vol. 6, Insekten, Teil III, Abt. 16:1-259.
- FAN, ZI-DE (1965), Key to the common synanthropic flies of China. Academy of Sciences, Peking, XV + 1-330.
- FAN ZI-DE (ed.), 1992, Key to the common flies of China. Second dition. Shangai Institute of Entomology, Academia Sinica. 992p + 40 pl.
- Kano, R., Flield, G. & Shinonaga, S. (1967), Sarcophagidae (Insecta: Diptera). Fauna Japonica 7:1-168 + 41 pls.
- Lehrer, A.Z., (1974), Diptères myiasigènes de la superfamille Sarcophagidea de Roumanie. Acta Rer. Nat. Mus. Nat. Slov., Bratislava, 20:125-159.
- Lehrer, A.Z., (2000a). Le système taxonomique des Sarcophaginae afrotropicales (Diptera, Sarcophagidae). Entomologica, Bari, 34:41-63.
- Lehrer, A.Z. (2000b), La structure de l’abdomen des Sarcophaginae (Diptera, Sarcophagidae). Entomologica, Bari, 34:153-169.
- Lehrer, A.Z., (2003a), Revision du genre Wohlfahrtia Brauer & Bergenstamm, 1889 de la faune d’Israël (Diptera, Sarcophagidae). Entomol. Croat., 7, nr. 1-2: 15-33.
- Lehrer, A.Z., (2003b), Sarcophaginae de l’Afrique (Insecta, Diptera, Sarcophagidae). Entomologica, Bari, 37 :5-528.
- Lehrer, A.Z., (2005), Nouveaux Sarcophagides afrotropicaux et orientaux (Diptera, Sarcophagidae). Entomologica, Bari, 39,:5-59.
- Lehrer, A.Z., 2006, Sarcophaginae et Paramacronychiinae du Proche Orient (Insecta, Diptera, Sarcophagidae). Pensoft, 1-263.
- Lehrer, A.Z., 2008, Le statut taxonomique des espèces "Musca carnaria Linnaeus, 1758" et Sarcophaga carnaria Bottcher, 1912 (Diptera, (Diptera, Sarcophagidae). Fragmenta Dipterologica, 13:15-17 [1].
- Lehrer, A.Z., 2010, Taxonomic Atlas of the postabdominal structures. SARCOPHAGIDAE (Insecta, Diptera), vol. 1, Entomologica, Bari,42 : 3-459, 418 figs.
- Lehrer, A. Z. & Fromunda V., 1986, Le développement larvaire du diptèremyiasigène Wohlfahrtia magnifica (Schiner) (Diptera, Sarcophagidae). Bull. Ann. Soc. r. bege Ent., 122:129-136
- Lehrer A., Lehrer M. & Verstraeten C., 1988, Les myiases causées aux moutons de Roumanie par Wohlfahrtia magnifica (Schiner) (Diptera, Sarcophagidae). Ann. Méd. Vét., 132:475-481.
- Lehrer, A. Z. & Luciano P., 1980, Sarcophagides (Diptera) parasites de Porthetria dispar (L.) en Sardaigne et leur cartographie dans le reseau U.T.M. Studi Sassaresi, Sez. III, Ann. Fac. Agraria Univ. Sassari, 27:161- 173.
- Lehrer, A. Z. & Verstraeten C., 1991, Expansion parasitologique et géographique de Wohlfahrtia magnifica (Schiner) (Diptera, Sarcophagidae) en Roumanie. Bull. Rech. Agron. Gembloux, 26(4):563-567.
- Leonide, J. & Leonide J.-C. (1986), Les diptères sarcophagidés des orthoptères français – essai biotaxonomie. Université de Provence (Aix-en-Provence), 1-301.
- Meigen, J.W. (1826), Systematische Beschreibung der bekannten europäischen zweiflügeligen Insekte. Fünfter Teil, Schulz, Hamm., 1-412.Mihàlyi, F. (1975), Beschreibung vier neuer Sarcophagidae Arten aus Ungarn (Diptera), Acta zool. hung., 21:101-108.
- Mihàlyi, F., (1979b), Fémeslefgyek - Húslegyek. Calliphoridae – Sarcophagidae. Fauna Hung., 135:1-152.
- Pape, T. (1987), The Sarcophagidae (Diptera) of Fennoscandia and Denmark. Fauna ent. scand., 19:1-203.
- Pape, T., 1996, Catalogue of the Sarcophagidae of the World (Insecta:Diptera). Mem. on Entomology, Intern., vol. 8, 558 p.
- Povolny D. & Verves, YU.G. (1997), The flesh-flies of Central Europa (Insecta, Diptera, Sarcophagidae). Spixiana. Supplement, München, 24 :1-260.
- Rohdendorf, B.B. (1937), Fam. Sarcophagidae. (P. 1). Faune de l'URSS, 19:1-501 [In Russian with German summary].
- Salem, H.H. (1935), The Egyptian species of the genus Sarcophaga. Publ. Egypt. Univ. Fac. Med., 5:1-61.
- Seguy, E. (1941), Études sur les mouches parasites. 2. Calliphoridae, calliphorines (suite), sarcophagines et rhinophorines de l'Europe occidentale et méridionale, Encycl. ent. (Ser. A), 21:1-436.
- Senior-White, R.A., Aubertin, D. & Smart, J. (1940), Diptera. Family Calliphoridae. The fauna of British India, including the remainder of the Oriental Region. Vol. VI. London, 1-288.
- Thompson, F.C. & Pont, A.C., 1993, Systematic Database of Musca Names (Diptera). These Zoologicae, 20, 221 p.
- Verves, YU. G. (1982), 64h. Sarcophaginae. Die Fliegen der plaearktischen Region, Stuttgart, Bd. 11, Lf. 327:235-296.
- Verves, YU. G. (1985), 64h. Sarcophaginae. Die Fliegen der plaearktischen Region, Stuttgart, Bd. 11, Lf. 330:297-440.
- Zumpt, F. (1972), Calliphoridae (Diptera Cyclorhapha). Part IV. Sarcophaginae. Explor. Parc nat. Albert, Miss. G.F. de Witte (1933-1935), 101:1-264.
Notes et références
- Lehrer, 2003c
- Voir la définition dans le Littré
- définition : qui possède des stigmates respiratoires sur le prothorax et le dernier segment abdominal
- NCBI, consulté le 25 mai 2010
- ITIS, consulté le 25 mai 2010
- Voir la nomenclature
Liens externes
Taxinomie:
- Référence Catalogue of Life : Sarcophagidae (en)
- Référence Fauna Europaea : Sarcophagidae (en)
- Référence ITIS : Sarcophagidae (fr) ( (en))
- Référence Animal Diversity Web : Sarcophagidae (en)
- Référence NCBI : Sarcophagidae (en)
- Référence uBio : Sarcophagidae Haliday, 1853 (en)
Wikimedia Foundation. 2010.