- Réaction de Barbier
-
La réaction de Barbier est une réaction organique entre un halogénure d'alkyle et un groupe carbonyle comme attracteur électrophile, en présence de magnésium ou aluminium ou zinc ou indium ou étain ou leurs sels. Cette réaction produit des alcools primaires ou secondaires ou tertiaires. La réaction de Barbier est similaire une addition nucléophile de Grignard mais la différence cruciale est que la réaction de Barbier est une synthèse one-pot alors que le réactif de Grignard est préparé séparément avant l'addition du composé carbonyle[1].
Les réactions de Barbier sont des additions nucléophiles qui généralement fonctionnent avec des métaux ou leurs composés relativement peu chers et peu sensibles à l'eau contrairement aux réactifs de Grignard ou aux organolithiens. Pour cette raison, il est possible dans de nombreux cas d'exécuter la réaction dans l'eau ce qui rejoint les objectifs de la chimie verte. La réaction de Barbier est ainsi nommée d'après Philippe Barbier, le directeur de thèse de Victor Grignard.
Sommaire
Exemples de réaction de Barbier
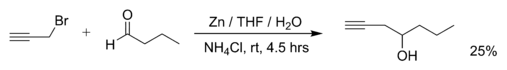
- La réaction du bromure de propargyle (3-bromopropyne) et du butanal avec du zinc métallique dans l'eau[2] :
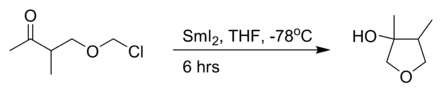
Avec un alcyne substitué plutôt qu'un alcyne terminal, La production du dérivé allénique est favorisée - La réaction de Babier intramoléculaire avec de l'iodure de samarium(II)[3]:
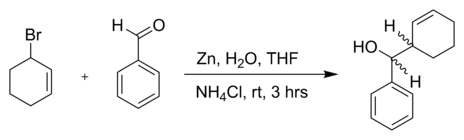
Cette reaction de Babier est accompagnée d'un réarrangement allylique vers un alcène terminal - Un autre bromure allylique dans une réaction avec le benzaldéhyde et de la poudre de zinc dans l'eau[5] :
La diastéréosélectivité observée pour cette réaction est érythro : thréo = 83 : 17 Réactions apparentées
- Réaction de Grignard
- Réaction de Nozaki-Hiyama-Kishi (en)
Note
- Barbier, P., « Synthèse du diéthylhepténol », dans Compt. Rend., vol. 128, 1899, p. 110 [texte intégral]
- Artur Jõgi and Uno Mäeorg, « Zn Mediated Regioselective Barbier Reaction of Propargylic Bromides in THF/aq. NH4Cl Solution », dans Molecules, vol. 6, 2001, p. 964–968 [texte intégral, lien DOI]
- Tore Skjæret and Tore Benneche, « Preparation of oxo-substituted α-chloro ethers and their reaction with samarium diiodide », dans Arkivoc, 2001, p. KU–242A [texte intégral]
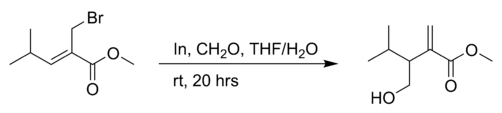
- George D. Bennett and Leo A. Paquette. "Methyl 3-(hydroxymethyl)-4-methyl-2-methylenepentanoate". Org. Synth.; Coll. Vol. 10: 77.
- Gary W. Breton, John H. Shugart, Christine A. Hughey, Brian P. Conrad, Suzanne M. Perala, « Use of Cyclic Allylic Bromides in the Zinc–Mediated Aqueous Barbier–Grignard Reaction », dans Molecules, vol. 6, 2001, p. 655–662 [texte intégral, lien DOI]
Liens externes
Wikimedia Foundation. 2010.