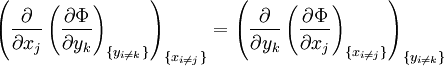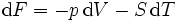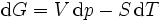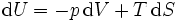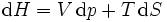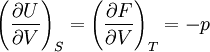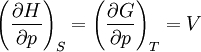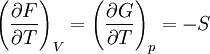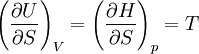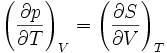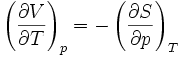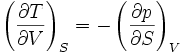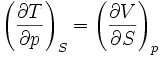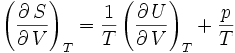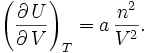- Relation de Maxwell
-
Relations de Maxwell
En thermodynamique, on appelle relations de Maxwell l'ensemble des équations aux dérivées partielles obtenues grâce aux définitions des potentiels thermodynamiques et à l'égalité de Schwarz. Pour un système entièrement décrit par les variables pression, température, entropie et volume, on retient généralement un ensemble de quatre relations relatives à l'énergie interne, à l'enthalpie, à l'énergie libre et à l'enthalpie libre. Néanmoins les relations de Maxwell sont généralisables à tous les systèmes thermodynamiques notamment chimiques, électriques et électrochimiques.
Sommaire
Définition générale
Soit un potentiel thermodynamique Φ dont les variables naturelles sont les variables conjuguées xi et yi. L'application du théorème de Schwartz permet d'obtenir :
Systèmes p, T, V, S
Pour les systèmes définis par les quatre variables pression, température, volume et entropie, on définit par l'intermédiaire de différentielles totales exactes quatre potentiels thermodynamiques :
Les relations de Maxwell qu'on en tire permettent notamment de définir thermodynamiquement la température, la pression, l'entropie et le volume.
on trouve aussi :Une application : première loi de Joule
Pour un gaz parfait, on a donc d'après ce qui précède
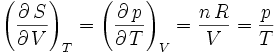 .
.
D'autre part,
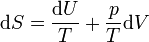 .
.
Soit:
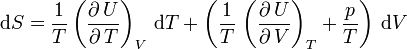 .
.
Ainsi,
d'où, d'après ce qui précède,
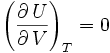 :
:
l'énergie interne d'un gaz parfait ne dépend que de sa température.
En effectuant ces calculs pour un gaz de van der Waals, c'est-à-dire un gaz dont l'équation d'état est
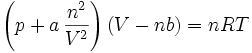 ,
,
on trouve
Cette méthode ne permet pas d'expliciter la dépendance de U en T : en effet, on sait par ailleurs qu'elle fait intervenir le coefficient de Laplace γ qui n'apparaît ni dans les identités thermodynamiques ni dans l'équation d'état.
Notations utilisées dans cet article
- V : Volume
- p : Pression
- T : Température
- U : Énergie interne
- H : Enthalpie
- F : Énergie libre
- G : Enthalpie libre
- S : Entropie
- R : Constante des gaz parfaits
- a et b : paramètres de l'équation d'état de van der Waals
- Portail de la physique
Catégorie : Thermodynamique
Wikimedia Foundation. 2010.