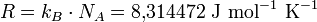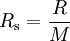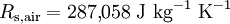- Constante des gaz parfaits
-
Constante universelle des gaz parfaits
La constante universelle des gaz parfaits (notée R, Rm ou Rn) est le produit du Nombre d'Avogadro (NA) et de la constante de Boltzmann (kB).
Ce produit vaut 8,314 472 J·mol-1·K-1 avec une incertitude de 0,000 015 J·mol-1·K-1 (source: CODATA; voir référence en fin d'article).
Valeurs de R Unités 8,314472 J⋅mol-1⋅K-1 0,0820578437 L⋅atm⋅K-1⋅mol-1 8,20574587×10-5 m3⋅atm⋅K-1⋅mol-1 62,3637 L⋅Torr⋅K-1⋅mol-1 83,14472 L⋅mbar⋅K-1⋅mol-1 1,987 cal⋅K-1⋅mol-1 6,132439833 lbf·ft·K-1·g·mol-1 10,7316 ft3·psi·°R-1·lb-mol-1 8,63×10-5 eV·K-1·atom-1 0,7302 ft3·atm·°R-1·lb-mole-1 Sommaire
Histoire
La constante universelle des gaz parfaits a été empiriquement déterminée en tant que constante de proportionnalité de l'équation des gaz parfaits. Elle établit le lien entre les variables d'état que sont la température, la quantité de matière, la pression et le volume. Elle est également utilisée dans de nombreuses autres applications et formules.
Il est tout sauf évident que la constante des gaz parfaits (dite aussi molaire) ait la même valeur pour tous les gaz idéaux et qu'elle soit universelle. On aurait pu supposer que la pression du gaz dépend de la masse molaire moléculaire, mais ce n'est pas le cas pour les gaz idéaux. Ce constat est exprimé par la Loi d'Avogadro, énoncée pour la première fois par Amedeo Avogadro en 1811.
Constantes spécifiques des gaz parfaits
constante spécifique du gaz Rs,
aussi appelée constante individuelle du gaz RiGaz Unités Internationales
[J·kg-1·K-1]Masse molaire
[g·mol-1]Argon, Ar 208 39,94 Dioxyde de carbone, CO2 188,9 44,01 Monoxyde de carbone, CO 297 28,01 Hélium, He 2077 4,003 Hydrogène, H2 4124 2,016 Méthane, CH4 518,3 16,05 Azote, N2 296,8 28,02 Oxygène, O2 259,8 31,999 Propane, C3H8 189 44,09 Dioxyde de soufre, SO2 130 64,07 Air 287 28,97 Vapeur d'eau, H2O 462 18,01 On obtient la constante spécifique (ou individuelle) d'un gaz, notée Rs, en divisant la constante universelle des gaz parfaits par la masse molaire du gaz.
La masse molaire de l'air sec vaut Ma = 28,9644 g/mol = 0,0289644 kg/mol. Ainsi, la constante spécifique de l'air sec vaut :
Le tableau ci-contre indique les valeurs des constantes spécifiques pour certains gaz.
La masse molaire M d'un gaz est une grandeur couramment utilisée pour identifier un gaz. L'on devrait ainsi éviter d'utiliser la constante spécifique des gaz, et plutôt utiliser la constante universelle des gaz parfaits avec la masse molaire.
Référence
Articles connexes
- (de) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en allemand intitulé « Universelle Gaskonstante ».
- Portail de la chimie
- Portail de la physique
Catégorie : Thermodynamique
Wikimedia Foundation. 2010.