- RCPG
-
Récepteurs couplés aux protéines G
Les récepteurs couplés aux protéines G (RCPG) sont une famille de récepteurs membranaires chez les mammifères.
L’organisme, sollicité en permanence par son environnement, est amené à analyser simultanément des milliers d’informations de natures diverses allant de simples photons à des molécules odorantes en passant par des hormones, acides aminés et nucléotides. La réception de ces informations et leur décodage par les cellules nécessitent la présence de récepteurs spécifiques présents à l’interface entre le milieu extra- et intracellulaire. Parmi ces récepteurs, les récepteurs couplés aux protéines G (RCPG) constituent la plus grande famille de récepteurs membranaires de mammifères puisqu’elle représente 3,4 % du génome[1]. Ces récepteurs doivent leur appellation à leur capacité de couplage, une fois activés, à des protéines hétérotrimériques liant le GTP (guanosine triphosphate), aussi appelées protéines G. Ces protéines transmettent le signal provenant du récepteur à différents effecteurs intracellulaires permettant la génération d’une réponse cellulaire appropriée. L’isolation puis le clonage des RCPG a permis d’identifier chez l’Homme autour de 900 gènes dont environ 500 correspondent aux récepteurs olfactifs et gustatifs et 400 à des récepteurs capables de lier des ligands endogènes[2]. Ainsi, l’hétérogénéité de ces récepteurs assure une reconnaissance très large de signaux tant externes (odeurs, lumière, molécules du goût) qu'internes (hormones et neurotransmetteurs).
Sommaire
Exemples de récepteurs couplés aux protéines G
- le récepteur muscarinique de l'acétylcholine ( voir récepteur métabotrope)
- les récepteurs à d'autres amines telles que la dopamine, la sérotonine, l'histamine ou la mélatonine
- les récepteurs de la FSH, de la LH et de la TSH
- les récepteurs des prostaglandines et leucotriènes
Structure des récepteurs couplés aux protéines G
 Figure 1. Structure des RCPG. Ce sont des récepteurs membranaires constitués de 7 hélices transmembranaires (TM) connectées par trois boucles extracellulaires et trois boucles intracellulaires. La liaison de molécules messages sur la face extracellulaire du récepteur permet l’activation au niveau intracellulaire de protéines G (échange GDP/GTP). Les protéines G, une fois activées, agissent à leur tour sur différents effecteurs responsables d’effets intracellulaires (d'après Bockaert et Pin).
Figure 1. Structure des RCPG. Ce sont des récepteurs membranaires constitués de 7 hélices transmembranaires (TM) connectées par trois boucles extracellulaires et trois boucles intracellulaires. La liaison de molécules messages sur la face extracellulaire du récepteur permet l’activation au niveau intracellulaire de protéines G (échange GDP/GTP). Les protéines G, une fois activées, agissent à leur tour sur différents effecteurs responsables d’effets intracellulaires (d'après Bockaert et Pin).
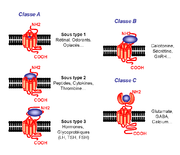
Les RCPG sont des protéines membranaires dont la masse moléculaire varie pour la plupart de 40 à 85 kDa (KiloDaltons). Il existe cependant des récepteurs beaucoup plus gros avec des masses moléculaires pouvant atteindre jusqu’à 620 kDa. Basés sur le modèle de la rhodopsine dont la structure tridimensionnelle a été résolue en 2000[3], les RCPG se caractérisent par une structure commune de sept hélices hydrophobes transmembranaires (TM), connectées par trois boucles extracellulaires et trois boucles intracellulaires (figure 1). Le domaine N-terminal orienté du côté extracellulaire est opposé au domaine C-terminal intracytoplasmique[4]. Selon des homologies de séquences, les RCPG sont référencés en trois classes majeures (figure 2)[5].
La classe A, avec comme archétype la rhodopsine, est la classe la plus représentée, composée entre autres des récepteurs aux catécholamines, chimiokines et glycoprotéines. Une vingtaine d’acides aminés très conservés représentent la signature de cette classe. Le haut degré de conservation de ces résidus sous-tend qu’ils pourraient jouer un rôle important dans la conservation de l’intégrité structurale et/ou fonctionnelle de ces récepteurs. Parmi ces acides aminés nous retiendrons l’aspartate du TMII et quatre résidus hydrophobes des TMVI et TMVII (proline, phénylalanine, asparagine) qui seraient importants pour l’activation des récepteurs ainsi que l’arginine du motif Asp-Arg-Tyr (DRY) entre le passage du TMIII et la boucle i2. À noter aussi la présence de deux cystéines sur les boucles extracellulaires e1/e2 engagées dans un pont disulfure et un site possible de palmitoylation après la courte hélice VIII située directement à la sortie du TMVII. Ce site de modification post-traductionnelle représente un point d’ancrage labile à la membrane plasmique pouvant former une quatrième boucle intracellulaire. Le site de liaison des ligands implique principalement les domaines transmembranaires ainsi que les boucles extracellulaires[6].
La classe B des RCPG se caractérise par un large domaine N-terminal extracellulaire (entre 100 et 500 acides aminés) contenant des cystéines conservées et engagées dans des ponts disulfures. Ces récepteurs sont capables de lier un grand nombre de peptides (calcitonine, sécrétine…) exclusivement au niveau des domaines extracellulaires (domaine N-terminal et boucles extracellulaires)[7].
La classe C comprend les récepteurs du glutamate, de l’acide gamma-aminobutyrique (GABAB), les récepteurs du calcium, trois récepteurs du goût, le récepteur GPRC6A ainsi que quelques récepteurs orphelins. Ces récepteurs sont caractérisés par un très grand domaine extracellulaire (~ 600 acides aminés) ressemblant aux protéines périplasmiques bactériennes, impliquées dans le transport d’acides aminés de sucres et d’ions[8].
Mécanisme d'activation des récepteurs couplés aux protéines G
Évolution des modèles
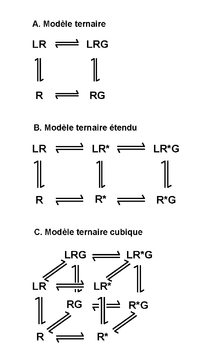
La reconnaissance des molécules messages par les récepteurs membranaires constitue la première étape de la communication cellulaire. Les premiers concepts formalisés vers le milieu du XIXe siècle étaient basés notamment sur la loi d’action de masse. Cette loi stipule la réversibilité de la liaison ligand – récepteur selon des constantes d’association et de dissociation.
Dans les années 1970-80, les premiers travaux réalisés sur le récepteur béta-2-adrénergique (β2AR) révèlent l’existence de deux populations différentes de récepteurs : une population de haute affinité et une autre de basse affinité pour le même ligand[9]. Le passage de la population de haute affinité vers une basse affinité dépend de la présence de magnésium (Mg2+) et de GTP et s’avère associé à une augmentation de l’activité de l’adénylate cyclase (un effecteur du β2AR) en réponse à la stimulation par l’agoniste[10]. Ces observations ont donné lieu à l’énoncé d’un modèle dit modèle ternaire mettant en jeu trois partenaires : le ligand, le récepteur et un facteur X indéterminé alors[11] mais identifié aujourd’hui comme étant la protéine G (figure 3.A). Plus tard différentes études, portant sur l'existence de formes constitutivement actives de récepteurs et sur la découverte de molécules capables de bloquer cette activité constitutive, permettront de générer un nouveau modèle ternaire étendu (figure 3.B). Il existerait un équilibre entre deux formes conformationnellement et fonctionnellement différentes pour un même récepteur, définies sous les termes de forme inactive (R) et forme active (R*)[12]. Cette isomérisation conformationnelle du récepteur (passage de R à R*) nécessite soit la fixation d’un ligand, soit des changements conformationnels spontanés, soit des mutations du récepteur.
Sur la base de cet équilibre, l’agoniste plein présente une forte affinité pour la forme active du récepteur (R*) et une faible affinité pour sa forme inactive (R). Sa fixation sur le récepteur favorise le déplacement de l’équilibre vers R* ce qui permet d’augmenter le nombre des protéines G activées. L’agoniste partiel a une préférence mais à un moindre degré pour la forme active du récepteur plutôt que pour sa forme inactive. Ainsi, la forme R* est moins représentée d’où un effet de plus faible intensité que l’agoniste plein. Les agonistes inverses, présentent une haute affinité pour la forme inactive du récepteur et une faible affinité pour sa forme active. Ils suppriment l’activité basale intrinsèque du récepteur[13]. Enfin, l’antagoniste sans activité propre, lie les formes actives et inactives du récepteur avec la même affinité. L’antagoniste compétitif bloque l’activité de l’agoniste en s’opposant à sa liaison sur le récepteur. Il se distingue de l’antagoniste non compétitif qui se fixe sur des sites différents de celui de l’agoniste (sites allostériques) mais empêche les changements conformationnels nécessaires à l’induction d’une réponse biologique.
Bien que le modèle ternaire étendu permette d’expliquer un certain nombre de situations, ce modèle n’envisage pas tous les cas de figures. Ainsi, un modèle plus complexe, dit modèle ternaire cubique, a été proposé[14] (figure 3.C). Ce modèle conserve les caractéristiques du modèle ternaire étendu mais diffère sur la capacité de couplage des récepteurs inactifs aux protéines G. Ce dernier point permet d’expliquer comment un agoniste inverse, préférentiellement lié à la forme inactive d’un récepteur, est capable d’induire la formation d’un complexe inactif à trois partenaires (ligand – récepteur – protéine G)[15].
À la lumière des données pharmacologiques récentes, les mécanismes moléculaires d’activation des RCPG semblent beaucoup plus complexes. En effet, un modèle récent suggère que la liaison d’un agoniste partiel ou plein stabilise des états conformationnels distincts, qui sont associés à des niveaux d’activation différents des récepteurs[16]. Ces différents états actifs sont définis par la capacité d’un ligand à rompre les interactions non covalentes qui stabilisent l’état basal. Le ligand se lie directement au niveau des acides aminés impliqués dans ces interactions et stabilise indirectement de nouvelles interactions intramoléculaires. Ces états conformationnels spécifiques d’un ligand donné peuvent être à l’origine des différentes voies de signalisation induites par un récepteur. Ainsi, les données de « ligand – trafficking » supportent ce modèle. En effet, des résultats de plus en plus nombreux montrent qu’en fonction du type de ligand utilisé pour activer un récepteur, les voies de signalisation induites peuvent être différentes[17]. La nature de l’agoniste va donc influencer l’état conformationnel du récepteur à l’état actif, favorisant ainsi certaines voies de signalisation.
Activation des protéines G
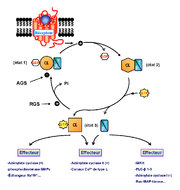 Figure 4. Cycle d’activation des protéines G hétérotrimériques. Dans son état actif, un RCPG peut activer une protéine G en la faisant passer d’un état trimérique lié au GDP (état 1) à un état vide de nucléotide de haute affinité pour le récepteur. Selon le modèle classique, la liaison du GTP présent à haute concentration dans la cellule, entraîne d'une part la dissociation du complexe récepteur - protéine G (état 2) et d'autre part la dissociation de la protéine G en ses deux sous-unités Gα et Gβγ (état 3). Néanmoins, de nouvelles données obtenues par des approches de transfert d’énergie ont relancé le débat sur le degré d’association de ces protéines au cours des processus d’activation.
Figure 4. Cycle d’activation des protéines G hétérotrimériques. Dans son état actif, un RCPG peut activer une protéine G en la faisant passer d’un état trimérique lié au GDP (état 1) à un état vide de nucléotide de haute affinité pour le récepteur. Selon le modèle classique, la liaison du GTP présent à haute concentration dans la cellule, entraîne d'une part la dissociation du complexe récepteur - protéine G (état 2) et d'autre part la dissociation de la protéine G en ses deux sous-unités Gα et Gβγ (état 3). Néanmoins, de nouvelles données obtenues par des approches de transfert d’énergie ont relancé le débat sur le degré d’association de ces protéines au cours des processus d’activation.
Les protéines G représentent les principaux effecteurs des RCPG et répondent toutes au même mécanisme d’activation (figure 4). À l’état inactif, la protéine G comprend les trois sous-unités Gα, Gβ et Gγ. La sous-unité Gα lie une molécule de GDP (guanosine diphosphate) au niveau de son domaine GTPase. Selon le modèle classique, l’activation du récepteur par son agoniste, se traduit par des modifications structurales qui favorisent le couplage du récepteur à la protéine G. Il en résulte une diminution de l’affinité de la sous-unité Gα pour le GDP, qu’elle expulse[18]. L’état de transition qui suit, bien qu’instable, n’en reste pas moins un état de haute affinité pour le récepteur. La fixation du GTP (présent à de hautes concentrations) au niveau de la sous-unité Gα « vide » clôture finalement cette première phase d’activation. La conséquence majeure de l’échange GDP/GTP semble être une dissociation du complexe hétérotrimérique : Gα-GTP et le complexe Gβγ [19]. Les sous-unités dissociées activent alors différents effecteurs spécifiques : adénylate cyclase (AC), phospholipase C (PLC)… Pour terminer le cycle, la déphosphorylation du GTP en GDP par l'action d'une RGS (Regulator of G-protein signaling) met fin au signal d’activation. Le complexe Gαβγ se recompose, stabilisant la liaison du GDP au niveau de la sous-unité Gα[20].
Ce modèle d’activation des protéines G, caractérisé par une dissociation du complexe hétérotrimérique avec un découplage des sous-unités α, βγ au niveau du récepteur, est remis en question et rediscuté au regard des données récentes obtenues dans ce domaine. Une hypothèse avait été avancée par Neubig et coll.. Selon ces auteurs, les récepteurs et les protéines G pourraient être pré-assemblés pour permettre une haute sélectivité d’interaction et favoriser ainsi des réponses rapides[21]. La mise au point de techniques de transfert d’énergie de type Förster (FRET, BRET) permet désormais d'analyser ces processus d’activation en cellules vivantes et de juger cette hypothèse. Les analyses et les interprétations du signal basal obtenues entre certains récepteurs et protéines G ainsi que les variations de transfert d’énergie détectées au cours des processus d’activation font actuellement débat. En effet, certaines données semblent confirmer le modèle d’association – dissociation[22] alors que d’autres supportent le concept de pré-assemblage du récepteur et de la protéine G[23]. Des divergences existent aussi sur la stabilité du complexe hétérotrimérique. La baisse de signal issue du transfert d’énergie entre les sous-unités α et βγ pourrait refléter une dissociation réversible de ces sous-unités au cours du processus d’activation[24]. Pour d’autres auteurs, cette baisse de signal est interprétée comme un simple changement de positionnement relatif des sous-unités α et βγ sans dissociation du complexe[25]. Toutes ces divergences reflètent certainement les difficultés d’interprétation et les limites liées aux techniques utilisées.
Transduction du signal
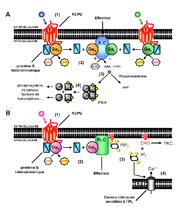 Figure 5. RCPG et seconds-messagers. A. Voie de signalisation AMPc dépendante. (1) activation du récepteur par un signal externe. (2) activation des protéines Gαs ou Gαi. (3) activation via Gαs ou inhibition via Gαi de la production d’AMPc par l’adénylate cyclase (A.C). (4) activation de la protéine kinase A (PKA) par l’adénosine monophosphate cyclique (AMPc) suite à la dissociation de ses sous-unités régulatrices (R) et catalytiques (C). B. Voie de signalisation inositol phosphate dépendante. (1) activation du récepteur par un signal externe. (2) activation de la protéine Gαq. (3) hydrolyse du phosphatidyl-inositol-4-5-diphosphate (PIP2) en inositol triphosphate (IP3) et diacylglycérol (DAG). (4) ouverture de canaux calciques du RE via l’IP3 et activation de la PKC via le DAG. Cette dernière va induire l’ouverture de canaux calciques présents au niveau de la membrane plasmique.
Figure 5. RCPG et seconds-messagers. A. Voie de signalisation AMPc dépendante. (1) activation du récepteur par un signal externe. (2) activation des protéines Gαs ou Gαi. (3) activation via Gαs ou inhibition via Gαi de la production d’AMPc par l’adénylate cyclase (A.C). (4) activation de la protéine kinase A (PKA) par l’adénosine monophosphate cyclique (AMPc) suite à la dissociation de ses sous-unités régulatrices (R) et catalytiques (C). B. Voie de signalisation inositol phosphate dépendante. (1) activation du récepteur par un signal externe. (2) activation de la protéine Gαq. (3) hydrolyse du phosphatidyl-inositol-4-5-diphosphate (PIP2) en inositol triphosphate (IP3) et diacylglycérol (DAG). (4) ouverture de canaux calciques du RE via l’IP3 et activation de la PKC via le DAG. Cette dernière va induire l’ouverture de canaux calciques présents au niveau de la membrane plasmique.
La liaison d’un ligand sur son récepteur et l’activation successive de la protéine G, représentent les deux premières étapes indispensables à la transmission d’un signal à l’intérieur de la cellule. La protéine Gα activée peut interagir avec différentes classes d’effecteurs dont l’adénylate cyclase et la phospholipase C (figure 5)[26].
L’Adénosine 3’, 5’-monophosphate cyclique (AMPc), considéré comme second messager, est produit à partir d’Adénosine triphosphate (ATP) par l’adénylate cyclase membranaire. La régulation de la concentration intracellulaire en AMPc est contrôlée par l’équilibre entre sa synthèse à partir d’ATP et sa dégradation rapide en 5'-AMP par une phosphodiestérase (PDE)[27]. Certains récepteurs peuvent contrôler la production d’AMPc en agissant via l’activation de protéines G spécifiques, capables de stimuler (Gs) ou inhiber (Gi) sa production.
D’autres protéines G sont associées à des voies de signalisation distinctes de celles déclenchées par les protéines Gαs ou Gαi. C’est le cas par exemple des protéines Gα activant la phospholipase Cβ. Cette enzyme membranaire, une fois activée par la sous-unité Gαq, clive le phosphatidyl-inositol-4,5-diphosphate en inositol-triphosphate (IP3) et en diacylglycérol (DAG). Ces deux seconds messagers agissent à leur tour comme des effecteurs : l’IP3 en se liant sur des canaux calciques du réticulum endoplasmique (RE) permet d’augmenter la concentration cytoplasmique en calcium et le DAG en agissant sur la Protéine Kinase C (PKC) favorise, entre autres, l’ouverture de canaux calciques membranaires.
Gβγ peut également moduler l'activité d'effecteurs au moins aussi nombreux que ceux contrôlés par les Gα. On retrouve des canaux potassiques à rectification entrante ("GIRK: G protein-coupled inwardly rectifying K+"), des enzymes (phospholipases A2 et C…)[28], l’adénylate cyclase[29] ainsi qu'un nombre important de kinases (MAP kinases, tyrosines kinases…).
Désensibilisation des récepteurs
 Figure 6. RCPG et seconds-messagers. Désensibilisation des RCPG. (a) activation d’un RCPG par un agoniste et déclenchement d’une signalisation cellulaire induite par les protéines G. (b) phosphorylation du domaine carboxy-terminal du récepteur par des GRK (G protein – coupled Receptor Kinase) et recrutement de la b-arrestine cytoplasmique au niveau du récepteur avec en parallèle un découplage de la protéine G. (c) formation des puits recouverts de clathrine et endocytose des récepteurs qui sont soit recyclés à la membrane plasmique soit dégradés via leur orientation vers les compartiments lysosomiaux.
Figure 6. RCPG et seconds-messagers. Désensibilisation des RCPG. (a) activation d’un RCPG par un agoniste et déclenchement d’une signalisation cellulaire induite par les protéines G. (b) phosphorylation du domaine carboxy-terminal du récepteur par des GRK (G protein – coupled Receptor Kinase) et recrutement de la b-arrestine cytoplasmique au niveau du récepteur avec en parallèle un découplage de la protéine G. (c) formation des puits recouverts de clathrine et endocytose des récepteurs qui sont soit recyclés à la membrane plasmique soit dégradés via leur orientation vers les compartiments lysosomiaux.
L’activation d’un RCPG par un agoniste induit non seulement le déclenchement de voies de signalisation mais aussi une régulation de l’activité du récepteur. Cette régulation dite « négative » permet un contrôle de la durée d’activation de manière à éviter les effets néfastes d’une stimulation prolongée du récepteur. Pour être effective cette régulation nécessite un découplage physique entre le récepteur et la protéine G (figure 6). Pour cela, le récepteur doit d’abord être phosphorylé sur des résidus sérine/thréonine, localisés dans son extrémité C-terminale[30].
Trois classes de protéines kinases susceptibles de réaliser cette phosphorylation se distinguent : les protéines kinases A ou C (PKA, PKC) activées par les seconds messagers (AMPc, calcium et DAG) qui phosphorylent le récepteur indépendamment de son état conformationnel[31] et les GRK (G protein Receptor Kinase) plus spécifiques des RCPG, qui phosphorylent le récepteur dans sa conformation active[32]. Concrètement, cette phosphorylation se traduit par le recrutement à la membrane plasmique d’une protéine cytosolique, la β-arrestine, qui prend probablement la place de la protéine G sous le récepteur[33].
Cette étape de translocation marque l’arrêt de la signalisation cellulaire induite par le récepteur activé. Une fois à la membrane, la β-arrestine devient alors un partenaire essentiel de la machinerie d’endocytose en permettant la formation des puits recouverts de clathrine, indispensables à l’internalisation du récepteur. La β-arrestine pourrait constituer un pont moléculaire entre les RCPG et le complexe AP-2. Cette proposition n'exclut pas une interaction directe entre la β-arrestine et la clathrine (Laporte et al., 2000). Le récepteur une fois internalisé peut suivre deux voies : soit il est dirigé vers des endosomes de recyclage, soit il est orienté vers le compartiment lysosomial[34]. Le pH acide des endosomes de recyclage peut favoriser la dissociation entre le ligand et le récepteur[35]. Le récepteur « vidé » de son ligand peut alors reprendre sa conformation de repos, être déphosphorylé par des phosphatases et être recyclé à la membrane plasmique : on parle de resensibilisation (récepteurs β2AR, récepteurs aux opiacés…)[36]. Cette resensibilisation permet d’éviter une désensibilisation prolongée des récepteurs, qui aboutirait à l’incapacité pour la cellule de répondre de manière appropriée à des signaux extracellulaires. En revanche, d’autres récepteurs sont dirigés vers les lysosomes où ils sont dégradés par des protéases (récepteur PAR-1 de la thrombine, récepteurs opiacés…)[37]. Ce mécanisme favorise vraisemblablement une transmission extrêmement transitoire du signal cellulaire. Le rôle de l’ubiquitination de certains RCPG dans leur orientation vers le compartiment lysosomal a récemment été démontré[38].
Notes et références
- ↑ Bockaert and Pin, 1999; Gershengorn and Osman, 2001
- ↑ Fredriksson and Schioth, 2005; Takeda et al., 2002; Vassilatis et al., 2003
- ↑ Palczewski et al., 2000
- ↑ Bockaert and Pin, 1999; Pierce et al., 2002; Schertler, 1998
- ↑ Bockaert and Pin, 1999
- ↑ Hibert et al., 1991; Kristiansen, 2004
- ↑ Trumpp-Kallmeyer et al., 1992
- ↑ Felder et al., 1999; O'Hara et al., 1993; Pin and Bockaert, 1995
- ↑ Kent et al., 1980; Lefkowitz et al., 1976
- ↑ Stadel et al., 1980
- ↑ De Lean et al., 1980
- ↑ De Lean et al., 1980; Gether and Kobilka, 1998; Kenakin, 2002b
- ↑ Barker et al., 1994; Chidiac et al., 1994
- ↑ Weiss et al., 1996
- ↑ Kenakin, 2004
- ↑ Yao et al., 2006
- ↑ Azzi et al., 2003; Kohout et al., 2004; Reversi et al., 2005
- ↑ Gilman, 1987; Neer, 1995
- ↑ Neer, 1995
- ↑ De Vries et al., 1995
- ↑ Neubig, 1994
- ↑ Hein et al., 2005
- ↑ Gales et al., 2005; Gales et al., 2006; Nobles et al., 2005
- ↑ Azpiazu and Gautam, 2004; Janetopoulos et al., 2001; Yi et al., 2003
- ↑ Bunemann et al., 2003
- ↑ Cabrera-Vera et al., 2003
- ↑ Simonds, 1999
- ↑ Katz et al., 1992; Kim et al., 1989
- ↑ Federman et al., 1992
- ↑ Bouvier et al., 1988; Hausdorff et al., 1989; Lohse et al., 1990
- ↑ Hausdorff et al., 1989
- ↑ Ferguson et al., 1996; Lohse et al., 1989
- ↑ Lohse et al., 1990
- ↑ Dery et al., 1999; Zhang et al., 1996
- ↑ Krueger et al., 1997
- ↑ Oakley et al., 2000
- ↑ Trejo and Coughlin, 1999
- ↑ Shenoy et al., 2001
- Portail de la biologie
Catégorie : Récepteur
Wikimedia Foundation. 2010.