- Papillome humain
-
Papillomavirus humain
VPH (HPV)
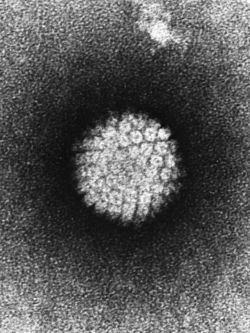
HPV au microscope électronique Classification classique Règne Virus Groupe Groupe I Famille Papovaviridae Genre Papillomavirus Espèce virus du papillome humain (VPH)
(Human papillomavirus — HPV)
Types :- HPV-1, 2, 4, 7
- HPV-11
- HPV-31, 33, 35, 51, 52, 58
- HPV-16, 18, 45, 46
Parcourez la biologie sur Wikipédia : Le virus du papillome humain (VPH), également appelé HPV pour Human papillomavirus, est un virus à ADN faisant partie de la famille des Papovaviridae. Il est responsable des infections sexuellement transmissibles les plus fréquentes puisque l'estimation des personnes contaminées par ce virus est comprise entre 10 et 30%.
Il existe plus de 200 génotypes de papillomavirus. Certains génotypes se transmettent par voie sexuelle et infectent les muqueuses génitales, d'autres se transmettent par contacts cutanés et infectent la peau.
Les manifestations cliniques les plus connues de la contamination sexuelles sont les condylomes acuminés (dits également « verrues génitales », ou « végétations vénériennes » ou « crêtes de coq »), déjà décrits par Hippocrate. Mais la gravité de cette infection est que certains génotypes sont le facteur obligatoire du cancer du col de l'utérus ; ce qui permet d'entrevoir, par la vaccination préventive contre ces virus, un espoir d'éradiquer un jour ce cancer.
Les manifestations cliniques cutanées de l'infection à HPV comprennent les verrues vulgaires et les verrues plantaires.
Enfin, la transmission peut se faire de la mère à son enfant lors de l'accouchement, bien que cela arrive rarement.
Sommaire
Virus
Papillomavirus ; virion non enveloppé, la capside est à symétrie cubique constituée de 72 capsomères en structure icosaédrique, de 55 nm de diamètre ; ADN bicaténaire, circulaire, fermé, réplication dans le noyau cellulaire. Virus nu, il est particulièrement résistant dans le milieu extérieur (froid, solvants organiques, détergents). Son génome est constitué de 8000 paires de bases.
- Virus ayant un tropisme pour les épithélium malpighiens
- Les papillomavirus humains appartiennent surtout au genre α-Papillomavirus. On en compte plus de 200 génotypes. 120 ont été identifiés et séquencés. Ils ont une spécificité d'hôte étroite (spécifique d'une espèce), ainsi qu'une spécificité de tissus.
- Ils sont désignés par un nombre en fonction de leur chronologie historique de découverte
- Il existe trois grands groupes :
- types muqueux et génitaux à potentiel cancérigène élevé : HPV-16, 18, 31, 33, 35, 45, 51, 52, 58 ...
- types muqueux et génitaux à faible potentiel cancérigène : HPV-6, 11 (papillomes et condylomes acuminés ano-génitaux)
- types cutanés : HPV-1, 2, 3, 4, 5, 7, 8, 10, 27, 57, 60, ...
Le génome des virus génitaux codent huit gènes (et autant de protéines)[1].
Épidémiologie
Les papillomavirus humains sont souvent présents sur la peau normale de sujets sains. On parle d'infections cutanées asymptomatiques, qui apparaissent très tôt dans l'enfance. La plupart des infections à papillomavirus sont latentes ou transitoires. Les lésions induites par ces virus régressent spontanément la plupart du temps.
Infections génitales
Ce sont les infections génitales qui ont été les plus étudiées.
Le HPV est la principale cause d'infections transmises sexuellement (ITS) aux États-Unis[2]. Bien que sa prévalence[3] soit élevée (près de 25 % de la population féminine pubère, elle est particulièrement importante chez la jeune femme de moins de 20 ans)[4] :- plus de la moitié des lésions de bas grade régressent spontanément en quelques années, 10 % évoluant vers des lésions de haut grade,
- environ un tiers des lésions de haut grade régressent spontanément, 5 % évoluant vers un cancer,
- au total, moins de 0,3 % des infections évoluent vers un cancer.
On considère ainsi que la majorité des personnes sexuellement actives ont eu au moins une infection à papillomavirus à potentiel cancérogène élevé au cours de leur vie, surtout au cours des premières années de la vie sexuelle.
Le virus se transmet par contact direct, par voie buccale, auto-inoculation (la transmission de verrues vulgaires est favorisée par le grattage) et par contact indirect (objets et surfaces contaminés - les locaux douches, piscines, etc. favorisent la propagation des verrues plantaires) ; la transmission est sexuelle dans le cas des condylomes ano-génitaux ; la transmission du papillome laryngien s'effectue de la mère à l'enfant lors du passage dans la filière génitale.
- De 1 % à 2 % des hommes et des femmes infectés présenteront des condylomes exophytiques cliniquement visibles.
- La période d’incubation est d’environ 2 à 3 mois pour les condylomes exophytiques, mais elle peut se calculer en années dans le cas des lésions précancéreuses ou cancéreuses.
- Les lésions exophytiques cliniquement visibles sont rarement associées au cancer :
- seuls certains génotypes du VPH sont associés aux cancers du col de l’utérus, de la vulve et du pénis, et au cancer anorectal. L'ADN de certains sérotypes d'HPV serait présent dans au moins 80-90 % des lésions cervicales dysplasiques (néoplasies cervicales intra-épithéliales) et des cancers du col de l'utérus (HPV 16, 18, 31, 33 ou 35)[5]. Les génotypes (HPV 6 et 11) qui causent le plus souvent les condylomes exophytiques n’ont pas été associés à ces cancers.
- La transmission périnatale d’une infection symptomatique semble rare.
- Lorsqu’elle survient, l’infection est associée à des lésions génitales et à des lésions des cordes vocales. On ignore la durée de la période d’incubation. Habituellement, la transmission périnatale devient cliniquement apparente au cours des 2 premières années de vie.
- Les patients infectés par le VIH présentent souvent des condylomes ano-génitaux étendus qui répondent peu au traitement.
- L’évolution vers le cancer est étroitement associée au tabagisme et à l’infection par le VIH.
Autres infections
Le papillomavirus humain (HPV) est également retrouvé au niveau d'autres épithéliums malpighiens[6], de la muqueuse oropharyngée mais surtout de la muqueuse œsophagienne. HPV y est souvent observé au sein de lésions bénignes ou malignes[7] où il induit la formation des cellules pathognomoniques de l'infection: les koïlocytes.
- Tumeurs bénignes de l'œsophage.
Les lésions bénignes au niveau de l'œsophage sont des papillomes viraux (ou SCP, squamous cell papillomas).
L'implication de HPV est fortement suspectée au vu de l'existence d'une koïlocytose plus ou moins prononcée dans ces lésions, mais la preuve n'en est apportée par PCR que dans 20% des cas (0% dans les pays à faible risque par exemple la Finlande[8], supérieur à 50% dans les pays à haut risque par exemple la Chine lors d'une campagne de dépistage du cancer de l'œsophage[9].
Ceci permet de penser que HPV (essentiellement les types 6, 11 et 16), s'il n'est pas suffisant pour induire la formation de papillomes, a très certainement un rôle de cofacteur dans l'apparition de ces tumeurs bénignes(Chang et al. 1991).
Il semble que très peu de papillomes puissent évoluer vers un carcinome épidermoïde[10].
- Tumeurs malignes de l'œsophage
Les tumeurs malignes de l'œsophage sont des carcinomes de type épidermoïde; les adénocarcinomes se développent quant à eux au niveau d'un oesophage de Barrett. HPV semble fortement impliqué dans l'étiologie des carcinomes épidermoïdes de l'œsophage (squamous cell carcinoma: SCC): on y retrouve également des koïlocytes.
La première étude prouvant le rôle d'un papillomavirus dans la genèse de lésions œsophagiennes est une étude animale[11]. Les bovins des Highlands en Ecosse présentent fréquemment des papillomes oesophagiens; expérimentalement, une papillomatose a été induite par le papillomavirus bovin 4 (BPV4)[12]. Ces animaux développent fréquemment des cancers de l'œsophage, et 96% des animaux qui présentent ce cancer sont également porteurs de papillomes BPV4-induits. On a démontré que l'ingestion de fougères (qui sont riches en carcinogène et en immunosuppresseurs, p.e. azathioprine) était un facteur de la transformation maligne des papillomes[13].
Chez l'homme, on retrouve fréquemment HPV par PCR dans les SCC (de 25% à 40% dans les études) de type 6, 11, 16, 18 et 30, mais le plus souvent de type 16[14]. Comme pour les lésions bénignes, on retrouve plus fréquemment HPV dans les coupes de SCC en provenance de pays à risque élevé ou à haut risque, que dans celles provenant de pays à faible risque[15].
Il est actuellement admis que HPV n'est qu'un cofacteur de carcinogénèse en ce qui concerne les carcinomes épidermoïdes de l'œsophage, agissant en synergie avec d'autres facteurs de risque (nitrosamines, mycotoxines, consommation d'opium, excés de tabac ou d'alcool...)[16].
Manifestations cliniques de l'atteinte génitale
- L’infection peut être subclinique ou clinique, mais elle est habituellement asymptomatique.
- Chez la femme, le col de l'utérus est le site le plus fréquent d’infection génitale à HPV. L’infection atteint souvent plusieurs sites (le col de l'utérus, le vagin, la vulve, etc.).
Condylome plat
Les lésions kératinisées légèrement surélevées.
Condylome acuminé
- Des excroissances sur la peau ou les muqueuses de la région ano-génitale sont souvent multiples et polymorphes avec apparence exophytique variant entre une excroissance digitiforme ou en chou-fleur et une lésion papuleuse.
- L’histoire naturelle de l’infection est marquée par une fluctuation de la taille et du nombre des condylomes et, dans bien des cas, par leur éventuelle disparition. La taille et le nombre des condylomes peuvent croître durant la grossesse.
- Ils peuvent également se présenter, en premier lieu, comme de vulgaires boutons auxquels on ne portera que très peu d'attention. la présence d'un seul "bouton" qui, comme présent depuis de nombreuses semaines, voir de nombreux mois, aura tendance à être "percé" ... Au quel cas, la propagation des lésions est annoncée si le diagnostique de condylomes est avéré ... Le signal d'alarme est alors à déclencher en cas de petit bouton persistant.
L'Homme-arbre
Dédé Koswara, pêcheur indonésien, fut longtemps surnommé « l'Homme-arbre » en raison de la spectaculaire affection qu'il a développée; il est porteur d'une affection génétique appelée épidermodysplasie verruciforme qui engendre l'impossibilité de développer une défense immunitaire vis à vis des papillomavirus à tropisme cutané. Son corps entier s'est couvert d'excroissances ayant l'aspect de champignons ou de racines, faisant paraître sa peau telle de l'écorce.
Dédé Koswara a finalement été opéré en 2008, et espère retrouver un aspect et une vie normale, même si une récidive n'est pas à exclure[17].
Pouvoir pathogène et génotype
Le pouvoir pathogène des papillomavirus humains dépend :
- du statut immunitaire de la personne infectée : les déficits immunitaires favorisent ce type d'infection (immunodépression congénitale, transplantations, HIV, traitements immuno-suppresseurs),
- de facteurs génétiques favorisant la transformation maligne des lésions dues aux HPV,
- du type d'HPV : les types HPV 6 et HPV 11 causent des lésions cutanées et muqueuses bénignes (verrues vulgaires, verrues plantaires, verrues planes, condylomes ano-génitaux, verrues génitales, épidermodysplasie verruciforme et papillomes laryngiens); les types HPV 16, 18, 31, 33 et 35 sont associés à des néoplasies cervicales intra-épithéliales et au cancer du col de l'utérus.
POUVOIR PATHOGÈNE ET TYPE DE PAPILLOMAVIRUS d'après[18]. (HR=haut risque oncogène, BR=bas risque) Lésions Type de papillomavirus Lésions cutanées Myrmécie 1 Verrues vulgaires 2-4-29-75-76-77 Verrues planes 3-10-28 Verrues intermédiaires 10-26-27-28-29 Verrues des bouchers 7 Maladie de Bowen 34 Kératoses actiniques 36 Kératoacanthome (un seul cas) 37 Mélanome (un cas) 38 Carcinome spinocellulaire 41-48 Lésions précancéreuses 49 Papillome maxillaire inversé 57 Kyste épidermoïde plantaire 60 Verrue myrmécie kystique 63 Verrues pigmentées 65 Lésions bénignes de l'épidermodysplasie verruciforme 5-8-9-12-14-15-17-19-20-22-23-24-25-36-46-47-49-59 Cancers de l'épidermodysplasie verruciforme 5-8-20-47 Lésions des muqueuses Condylomes de la muqueuse génitale 6-11-54 (BR) Néoplasie intraépithéliale anogénitale 34-40-42-43-57-59-61-62-64-67-68-69 (BR) Papulose bowénoïde 34-55 (BR) Papillome vulvaire 42-70 (BR) Hyperplasie vulvaire 43 (BR) Condylomes anogénitaux 44 (BR) Néoplasie intraépithéliale anale 71-74 (BR) muqueuse orale : maladie de Heck 12-32 (BR) papillomes oraux (immunodéprimés) 72-73 (BR) Cancer anogénital 16-18-30-31-33-35-39-45-52-56-58-66-69 (HR)[19],[20] Néoplasie intraépithéliale anogénitale 35-39-45-52-56-58-69 (HR) Néoplasie intraépithéliale et cancers génitaux 51 (HR) Cancers oraux et laryngés 30 (HR) Diagnostic
- Le diagnostic se fait par examen direct des organes génitaux externes, à l’aide d’une loupe ou d’un colposcope éventuellement aidé par l'application d'acide acétique à 5%, et de lugol.
- Le diagnostic d'infection génitale à HPV 16 ou 18 se fait par recherche d'ADN viral (par "capture hybride" par des sondes d'ARN, ou par amplification génique (polymerase chain reaction, ou PCR), in vitro) lors de la réalisation d'un frottis. Cependant ce test est basé sur la détection de l’ADN des virus. Un résultat positif démontre uniquement la présence du virus mais la valeur prédictive positive pour le risque de développement d’un cancer est faible (de 10 à 20%).
- Le diagnostic d'infection génitale à HPV se fait aussi par recherche d'ARNm viral (Nuclisens EasyQ HPV). L’expression des oncoprotéines virales E6 et E7 initie le processus de cancer en affectant le contrôle du cycle cellulaire. Ce nouveau test de dépistage est basé sur la détection des ARNm des oncoprotéines E6 et E7 dans les cellules humaines. Les ARNm des oncoprotéines E6 et E7 sont des marqueurs prédictifs de l’activité oncogénique des HPV permettant d’identifier les femmes à risque de développer un HSIL (CIN2/3) et un carcinome du col utérin. Le principe de ce test repose sur l’amplification et la détection des ARNm E6/E7 par NASBA (Nucleic Acid Sequence-Based Amplification) en temps réel[21].
- Il n’existe pas de test sérologique sur le marché.
Évolution et complications
De nombreuses lésions dues au HPV passent inaperçues et guérissent toutes seules, ne laissant pas de trace immunologique (sérologie), c’est ce qui explique leur transmissibilité aussi facile. Mais la plupart des cancers du col de l’utérus sont dus à HPV.
Le dépistage du cancer du col est très important : un examen gynécologique périodique avec un frottis cervical est le seul moyen. Il est simple et peu coûteux : il permet de découvrir des cancers débutant et de les traiter sans tarder.
Le Papillomavirus HPV6 semble également responsable du cancer de l'anus, relativement rare (représentant environ 3 % des tumeurs malignes de l'anus et du rectum, survenant essentiellement après 60 ans, trois fois plus chez la femme que chez l'homme).
Enfin il existe actuellement une augmentation des carcinomes épidermoïdes pharyngés associés à une infection à HPV. Sans que le lien causal soit encore établi, on suppose que ces tumeurs sont directement induite par l'infection.
Traitement et prise en charge
Il n'existe aucun traitement permettant la guérison d'une infection à papillomavirus. La destruction des lésions visibles peut être cependant faite de manière plus ou moins simple. Les lésions du col de l’utérus sont traitées par la cryothérapie (application d’azote liquide) par le laser, voire par la chirurgie, soit en enlevant une partie du col (conisation) , soit en l'ôtant en totalité. Des traitements locaux sont également possibles (Podofilox solution ou gel à 0,5 %, Podophylline à 10-25 % qui ne doit être appliquée que par un médecin).
D'autres traitements stimulateurs de l'immunité sont actuellement en cours de développement.
Après le traitement, il se peut que le virus soit toujours présent même si les condylomes ont disparu. Il est donc important de surveiller la réapparition des lésions pendant plusieurs mois après la résection.
- L’immunité à médiation cellulaire peut permettre d’éradiquer le HPV avec le temps[réf. nécessaire].
- Les condylomes sont souvent très persistants et récurrents. Cependant, on observe une disparition complète des condylomes génitaux externes chez 80 % des patients qui en présentent. Les lésions cervicales disparaissent dans environ 90 à 95 % des cas.
Prévention
- le préservatif diminue en grande partie la transmission des papillomavirus et la fréquence des infections persistantes à HPV (ce qui signifie que l'utilisation régulière du préservatif entraine une régression des lésions préexistantes plus fréquentes que chez ceux qui ne l'utilisent pas). Il peut y avoir cependant contamination par contact avec des zones cutanées non couvertes par le préservatif.
- En octobre 2005 est sorti un vaccin contre le papillomavirus type 6, 11, 16 et 18. Cette vaccination nommé Gardasil est de nature à prévenir les lésions précancéreuses et les cancers non invasifs du col de l'utérus dus aux papillomavirus de type 6, 11, 16 et 18[22].
- L'immunité conférée dure au moins cinq ans. Son efficacité est quasi totale (98%)[23] chez les femmes non infectées par un des virus contenus dans le vaccin. Il ne paraît pas efficace, ni pour les autres génotypes, ni pour les femmes déjà infectées. L'efficacité n'est pas connue au-dela de cinq ans, notamment en raison de la longueur de développement du cancer du col de l'utérus.
- La vaccination concerne surtout les adolescentes avant les premières relations sexuelles, soit à l'âge de 14 ans[24], et c'est ce que recommande le CSHPF qui préconise une vaccination systématique à cet âge. Elle ne dispense pas de la poursuite du dépistage du cancer du col de l'utérus ni de l'utilisation du préservatif.
Article détaillé : Vaccin contre HPV.Sources
- (fr) Lignes directrices canadiennes pour les maladies sexuellement transmissibles
- Revue Prescrire n°280 fév2007, « les papillomavirus humains » p112-117
Notes et références
- ↑ Schiffman M, Castle PE, Jeronimo J, Rodriguez AC, Wacholder S, Human papillomavirus and cervical cancer, Lancet, 2007;370:890-907
- ↑ (en)Weinstock H, Berman S, Cates W. , Sexually transmitted infections in American youth: incidence and prevalence estimates, 2000. Perspect Sex Reprod Health. 2004;36:6-10
- ↑ l'estimation de la prévalence dépend en fait des techniques utilisées pour la détection des papillomavirus : recherche du génome, d'anticorps spécifiques. La présence de virus ne signifie pas pour autant qu'il y a infection symptomatique
- ↑ Eileen F. Dunne, Elizabeth R. Unger, Maya Sternberg, Geraldine McQuillan, David C. Swan, Sonya S. Patel, Lauri E. Markowitz. Prevalence of HPV infection among females in the United States, JAMA. 2007;297:813-819
- ↑ (en) Walboomers JM, Jacobs MV, Manos MM, et al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J Pathol. 1999;189:12-19
- ↑ Syrjänen K. et Syrjänen S. 2000. Papillomavirus infections in human pathology. J. Wiley and Sons, New York
- ↑ SyrjänenKJ. 1982. Histological changes identical to thoses of condylomatous lesions found in esophageal squamous cell carcinomas. Arc. Geschwulstforsch, 52:283-292
- ↑ Chang F.,Janatuinen E., Pikkarainen P., Syrjänen S., Syrjänen K., (1991). Esophageal squamous cell papillomas. Failure to detect human papillomavirus DNA by in situ hybridization and polymerase chain reaction. Scand. J. Gastroenterol., 26:535-545
- ↑ Li T, Lu ZM, Chen KN, Guo M, Xing HP, Mei Q, Yang HH, Lechner JF, Ke Y (2001). Human papillomavirus type 16 is an important infection factor in the high incidence of esophageal cancer in Anyang area of China. Carcinogenesis, 22:929-934
- ↑ Van Custen E., Geboes K., Vantrappen G. (1992). Malignant degeneration of esophageal squamous papilloma associated with the human papillomavirus. Gastroenterol., 103:1119-1120
- ↑ Jarrett WFH, McNeil PE, Grimshaw TR, Selman IE, McIntyre WIM (1978). High incidence area cattle cancer with a possible interaction between an environmental carcinogen and a papillomavirus. Nature, 274:215-217.
- ↑ Jarrett WFH (1987). Environmental carcinogens and papillomaviruses in the pathogenesis of cancer. Proc. R. Soc. Lond. B., 231:1-11.
- ↑ Campo MS (1987). Papillomas and cancer in cattle. Cancer Surv., 6:39-54.
- ↑ Chang F, Syrjänen S, Shen Q, Ji HX, Syrjänen K ( 1990). Human papillomavirus (HPV) DNA in esophageal precancer lesons and squamous cell carcinomas from China. Int. J. Cancer, 45:21-25.
- ↑ Chang F, Syrjänen SM, Wang I, Syrjänen K (1992). Infectious agents in the etiology of esophageal cancer. Gastroenterology, 103:1336-1348.
- ↑ Miller BA, Davidson M, Myerson D, Icenogle J, Lanier AP, Tan J, Beckmann AM (1997). Human papillomavirus type 16 DNA in esophageal carcinomas from Alaska natives. Int. J. Cancer, 71:218-222.
- ↑ Article relatant l'opération
- ↑ Majewski S. Jablonska S. Human papillomavirus-associated tumors of the skin and mucosa. J Am Acad Dermatol 1997; 36: 659-685
- ↑ selon une étude australienne, HPV-16, 18, 45 sont présents dans plus de 70% des cancers du col de l'utérus (respectivement 53%, 18% et 6%) : ce lien est particulièrement fort dans le carcinome épidermoïde, et moindre dans l'adénocarcinome
- ↑ principalement HPV-16 pour le Carcinome épidermoïde du col de l'utérus, HPV-18 pour le Adénocarcinome du col de l'utérus
- ↑ Test Nuclisens EasyQ HPV de Biomérieux
- ↑ selon l'AMM, ses indications sont la prévention des dysplasies de haut grade du col de l'utérus, des cancers du col de l'utérus, des dysplasies de haut grade de la vulve et des verrues génitales externes dus aux papillomavirus humains de types 6, 11, 16, 18
- ↑ HAS Avis de la commission de transparence
- ↑ 3% des premiers rapports sexuels ont lieu avant l'âge de 15 ans
- Portail de la médecine
Catégories : Infection virale | Maladie sexuellement transmissible | Microbiologie en gynécologie-obstétrique | Papillomavirus
Wikimedia Foundation. 2010.

