- PH-mètre
-
Un pH-mètre est un appareil, souvent électronique, permettant la mesure du pH d'une solution.
Sommaire
Fonctionnement
Le pH-mètre est généralement constitué d'un boîtier électronique permettant l'affichage de la valeur numérique du pH et d'une sonde de pH constituée d'une électrode de verre permettant la mesure et d'une électrode de référence. Son fonctionnement est basé sur le rapport qui existe entre la concentration en ions H3O + (définition du pH) et la différence de potentiel électrochimique qui s'établit dans le pH-mètre une fois plongé dans la solution étudiée.
Celui-ci est constitué de deux électrodes, l'une standard dont le potentiel est constant et connu (appelée électrode de référence), l'autre à potentiel variable (fonction du pH, appelée électrode de verre). Ces deux électrodes peuvent être combinées ou séparées.
Une fois l'appareil étalonné à l'aide de deux solutions tampon (souvent de pH 4, 7 et 10), on peut déterminer la valeur du pH par simple corrélation, la différence de potentiel évoluant proportionnellement à la valeur du pH selon la formule :
- ΔE est la différence de potentiel entre les deux électrodes
- pHa est le pH de la solution à mesurer
- pHb est le pH de la solution de référence
- a et b dépendent de l'appareil, ils sont révélés lors de l'étalonnage du pH-mètre
Étalonnage
Le pH-mètre est étalonné avant chaque campagne de mesures (par exemple tous les matins) avec deux solutions tampon. Selon les mesures à effectuer, on étalonne par exemple par une solution de pH=7 puis par une solution de pH=4 pour faire des mesures en milieu acide, ou par une solution de pH=7 puis une solution de pH=10 pour des mesures en milieu basique. Les valeurs des mesures sont idéalement comprises entre les deux valeurs de pH des solutions tampon utilisées (les valeurs de pH=4, 7 et 10 sont les plus communément rencontrées parmi les solutions tampon).
Mesure et conservation de la sonde
Après chaque mesure, la sonde de pH est rincée un court instant à l'eau purifiée (eau déminéralisée, déionisée, distillée, etc.).
Une fois la campagne réalisée, la sonde doit être rincée, puis rapidement immergée dans le liquide de conservation indiqué par le constructeur (exemples, suivant le modèle de sonde : solution tampon de pH=4, électrolyte spécial).
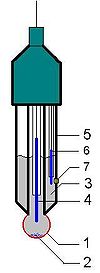
Schéma de la sonde à pH
- Corps de l'électrode de verre
- Cristaux de KCl (visibles dans certains cas lorsque la solution est sur-saturée)
- Solution saturée en KCl
- Fil conducteur relié à l'électrode de verre
- Verre actif
- Électrode de référence au calomel (autre possibilité : électrode à Ag/AgCl)
- Jonction électrolytique
Voir aussi
- Arnold Orville Beckman, chimiste, inventeur du pH-mètre.
- RH-mètre
Wikimedia Foundation. 2010.