N,N-diméthylaniline
- N,N-diméthylaniline
-
Diméthylaniline
- Cet article traite de la N,N-diméthylaniline. Pour les autres isomères, voir l'article « Xylidine ».
| Diméthylaniline |
|
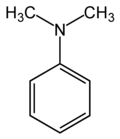
Structure de la diméthylaniline |
| Général |
| Nom IUPAC |
N,N-diméthylaniline |
| Synonymes |
DMA |
| No CAS |
121-69-7 |
| No EINECS |
204-493-5 |
| SMILES |
|
| Apparence |
Liquide incolore |
| Propriétés chimiques |
| Formule brute |
C6H11NC6H5N(CH3)2 |
| Masse molaire |
97,1582 g∙mol-1
C 74,17 %, H 11,41 %, N 14,42 %,
|
| Propriétés physiques |
| T° fusion |
2 °C |
| T° ébullition |
194 °C |
| Masse volumique |
956 kg/m3 |
| Précautions |
|
Directive 67/548/EEC
|

T
|

N
|
|
Numéro index :
612-016-00-0
Symboles :
T : Toxique
N : Dangereux pour l`environnement
Phrases R :
R40 : Effet cancérogène suspecté. Risque possible d’ effets irréversibles.
R23/24/25 : Toxique par inhalation, par contact avec la peau et par ingestion.
R51/53 : Toxique pour les organismes aquatiques, peut entraîner des effets néfastes à long terme pour l’ environnement aquatique.
Phrases S :
S28 : Après contact avec la peau, se laver immédiatement et abondamment avec … ( produits appropriés à indiquer par le fabricant).
S45 : En cas d’ accident ou de malaise, consulter immédiatement un médecin ( si possible, lui montrer l’ étiquette).
S61 : Éviter le rejet dans l’ environnement. Consulter les instructions spéciales/ la fiche de données de sécurité.
(S1/2) : Conserver sous clef et hors de portée des enfants.
S36/37 : Porter un vêtement de protection et des gants appropriés.
|
| Phrases R : 23/24/25, 40, 51/53, |
| Phrases S : (1/2), 28, 36/37, 45, 61, |
|
Classification du CIRC
|
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[1] |
|
Unités du SI & CNTP, sauf indication contraire.
|
La diméthylaniline est un composé chimique de formule C6H5N(CH3)2, plus précisément l'isomère ayant deux groupes méthyle sur l'azote de l'aniline, appelé pour cette raison N,N-diméthylaniline dans la nomenclature UICPA. Il s'agit donc d'une amine aromatique tertiaire, qui se présente normalement sous forme d'un liquide huileux incolore lorsqu'il est pur, mais dont les échantillons commerciaux sont généralement jaunâtres.
Préparation et réactions
La diméthylaniline est produite industriellement par alkylation de l'aniline en présence d'un catalyseur acide[2] :
- C6H5NH2 + 2 CH3OH → C6H5N(CH3)2 + 2 H2O
La DMA donne la plupart des réactions de l'aniline. Elle est faiblement basique, et réagit avec les électrophiles. Sa nitration donne du tétryle (ou tétralyte), un dérivé à quatre groupes nitro utilisé autrefois comme explosif. Elle peut être lithiée avec le butyllithium. Sa méthylation donne un sel d'ammonium quaternaire[3] :
- C6H5N(CH3)2 + → [C6H5N+(CH3)3][CH3OSO3]–
Applications
La diméthylaniline est utilisée dans la réticulation de résines polyester et vinyl ester. Elle intervient également comme précuseur dans d'autres synthèses organiques.
Références
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ Thomas Kahl, Kai-Wilfrid Schröder, « Aniline » dans Ullmann's Encyclopedia of Industrial Chemistry 2007, John Wiley & Sons, New York.
- ↑ (en) J. Jacques et A. Marquet, Selective α-Bromination of an Aralkyl Ketone with Phenyltrimethylammonium Tribromide: 2-Bromoacetyl-6-methoxynaphthalene and 2,2-Dibromoacetyl-6-Methoxynaphthalene, 1988
 Portail de la chimie
Portail de la chimie
Catégories : Produit chimique toxique | Produit chimique dangereux pour l'environnement | Aminobenzène
Wikimedia Foundation.
2010.
Contenu soumis à la licence CC-BY-SA. Source : Article N,N-diméthylaniline de Wikipédia en français (auteurs)
Regardez d'autres dictionnaires:
Dimethylaniline-N-oxide aldolase — Identifiers EC number 4.1.2.24 CAS number 37290 58 7 … Wikipedia
Dimethylaniline — (kurz DMA) ist der Name von verschiedenen isomeren chemischen Verbindungen, genauer von aromatischen Aminoverbindungen bzw. Anilinderivaten, wobei sich die Aminogruppe am Ring befindet. Bekannte Einzelstoffe sind: N,N Dimethylanilin N,2… … Deutsch Wikipedia
diméthylaniline — ● diméthylaniline nom féminin Arylamine (CH3)2N―C6H5, utilisée dans la fabrication des colorants … Encyclopédie Universelle
Diméthylaniline — Cet article traite de la N,N diméthylaniline. Pour les autres isomères, voir l article « Xylidine ». Diméthylaniline Structure de la diméthylaniline Général … Wikipédia en Français
Dimethylaniline — This article is about N,N dimethylaniline. For other constitutional isomers, see xylidine. N,N Dimethylaniline IUPAC name … Wikipedia
dimethylaniline — noun The tertiary amine CHN(CH) used in the manufacture of the explosive tetryl … Wiktionary
dimethylaniline — di·meth·yl·aniline … English syllables
dimethylaniline — /ˌdaɪmɛθəlˈænəlin/ (say .duymethuhl anuhleen) noun → xylidine (def. 1). {di 1 + methyl + aniline} …
dimethylaniline — (ˌ)dīˌmethə̇l+ noun Etymology: International Scientific Vocabulary dimethyl + aniline : a yellowish to brownish oily liquid compound C6H5N(CH3)2 made by methylating aniline and used chiefly as an intermediate (as in dye manufacture) * * *… … Useful english dictionary
N,N-dimethylaniline — N,N dimetilanilinas statusas T sritis chemija formulė C₆H₅N(CH₃)₂ atitikmenys: angl. N,N dimethylaniline rus. N,N диметиланилин ryšiai: sinonimas – fenildimetilaminas … Chemijos terminų aiškinamasis žodynas



