- Méthanolate de sodium
-
Méthanolate de sodium 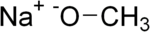
Général Nom IUPAC méthanolate de sodium Synonymes méthylate de sodium
méthoxyde de sodiumNo CAS No EINECS PubChem SMILES InChI Apparence poudre blanche Propriétés chimiques Formule brute CH3NaO Masse molaire[1] 54,0237 ± 0,0013 g·mol-1
C 22,23 %, H 5,6 %, Na 42,55 %, O 29,62 %,Propriétés physiques T° fusion 280 °C (décomposition) [2] Masse volumique 1,3 g·cm-3 à 20 °C [2] T° d'auto-inflammation 240 °C [2] Thermochimie S0solide 110,58 J·mol-1·K-1 [3] ΔfH0solide -375,9 kj·mol-1 [3] Cp 69,45 J·mol-1·K-1 (solide,20 °C) [3] Précautions Directive 67/548/EEC 
C
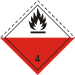
FPhrases R : 11, 14, 34, Phrases S : 1/2, 8, 16, 26, 43, 45, Transport 48 1431 Écotoxicologie DL50 2,037 g·kg-1 (rat, oral) [4] Unités du SI & CNTP, sauf indication contraire. Le méthanolate de sodium ou méthylate de sodium est le composé chimique de formule brute CH3ONa. C'est un solide incolore qui est formé par déprotonation du méthanol et qui est un réactif très largement utilisé dans l'industrie et en laboratoire. C'est une base forte dangereuse.
Sommaire
Préparation et structure
Le méthanolate de sodium est préparé en traitant prudemment du méthanol sec avec du sodium :
- Na + HOCH3 → NaOCH3 + 1/2 H2
Cette réaction est si exothermique qu'une inflammation est possible. La solution résultante, incolore, est souvent utilisée telle quelle comme source de méthanolate de sodium. Cependant, le composé pur peut être isolé par évaporation suivi d'un chauffage pour éliminer les résidus de méthanol. L'eau hydrolyse le méthanolate de sodium donnant de l'hydroxyde de sodium (NaOH) et de fait, le composé commercial est souvent contaminé par de l'hydroxyde. Le méthanolate de sodium, et spécialement ses solutions, absorbe le gaz carbonique (CO2) de l'air ce qui en diminue la basicité.
Dans sa forme solide, le méthanolate de sodium est polymérique avec des plans d'ions Na+, chacun étant lié à quatre atomes d'oxygène[5].
La structure et donc la basicité du méthanolate de sodium en solution dépend du solvant. C'est une base significativement plus forte dans le DMSO où il est plus largement ionisé et libre de liaison hydrogène[6].
Applications
Synthèse organique
Le méthanolate de sodium est une base de routine en chimie organique, applicable dans la synthèse de nombreux composés, aussi bien de la pharmacie qu'en agrochimie[6]. Par exemple, il est employé comme base pour les déshydrohalogénations[7] ou les condensations aldoliques. C'est aussi un nucléophile pour la production d'éthers méthyliques[8].
Dans l'industrie
Le méthanolate de sodium est utilisé comme un initiateur pour la polymérisation (addition anionique) de l'oxyde d'éthylène qui forme des polyéthers avec de hauts poids moléculaire. Le biodiesel est préparé à partir de graisses végétales ou animales qui sont de fait des triglycérides, c'est-à-dire des esters du glycérol avec trois acides gras, par transestérification avec du méthanol pour donner des esters méthyliques d'acides gras. Cette réaction est catalysée par le méthanolate de sodium.
Sécurité
le méthanolate de sodium est très caustique et son hydrolyse donne du méthanol qui est volatil et toxique.
Notes
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Sodium methoxide » (voir la liste des auteurs)
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Entrée de « Sodium methylate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 28 juin 2009 (JavaScript nécessaire)
- (en) « Sodium methoxide » sur NIST/WebBook, consulté le 28 juin 2009
- (en) « Sodium methoxide » sur ChemIDplus, consulté le 28 juin 2009
- Die Kristallstruktur des Natriummethylats, E. Weiss; Zeitschrift fur Anorganische und Allgemeine Chemie 1964, vol. 332, pp. 197-203. DOI:10.1002/zaac.19643320311
- Y. El-Kattan, J. McAtee, B. Bessieres; Sodium Methoxide in Encyclopedia of Reagents for Organic Synthesis, John Wiley & Sons, 2006, New York. DOI:10.1002/047084289X.rs089m.pub2
- Jacques Drouin, Introduction à la chimie organique : Les molécules organiques dans votre environnement. Usages, toxicité, synthèse et réactivité, Librairie du Cèdre, 1re éd. (ISBN 2-916346-00-7), p. 362
- Frederic Reverdin; 3,5-Dinitroanisole, OrgSynth, collvol 1, p. 219
Voir aussi
- Alcoolate
- (en) Methoxide
- (en) Biodiesel production
Wikimedia Foundation. 2010.