- Modèle de Lewis
-
Formule de Lewis
En chimie, une formule de Lewis est une représentation en 2 dimensions permettant de représenter la structure électronique externe des atomes composant une molécule. Inventée par Gilbert Lewis, elle se base sur la topologie de la molécule (connexion entre les atomes par des liaisons covalentes).
Sommaire
Définition
La représentation de Lewis consiste à définir l'allocation des électrons sur ou entre les atomes de la molécule. Seuls les électrons de valence sont considérés. On obtient ainsi une certaine vision de la structure électronique de la molécule par ses doublets libres, ses doublets liants (liaisons σ et π), ses lacunes et ses éventuels électrons célibataires (dans le cas des radicaux).
Un code de représentation
Dans cette représentation, les électrons célibataires sont notés par des points et les paires d'électrons par des traits (plus rarement par deux points). Les traits peuvent être localisés sur un atome (doublet libre ou non liant) ou entre les atomes (doublet liant, liaison covalente).
Construction
La construction du modèle de Lewis d'une molécule se base sur la détermination de la valence des atomes la constituant, ce qui définit le nombre total d'électrons externes de la molécule. L'établissement de la structure de Lewis, consiste à répartir ces électrons sur le squelette moléculaire tout en respectant la règle de l'octet. Le squelette moléculaire est fait de liaisons σ qui mobilisent chacune 2 électrons sur le total des électrons de valence de la molécule. Une structure de Lewis est d'autant plus probable qu'elle respecte l'octet et ne présente pas de séparation de charge.
Exceptions
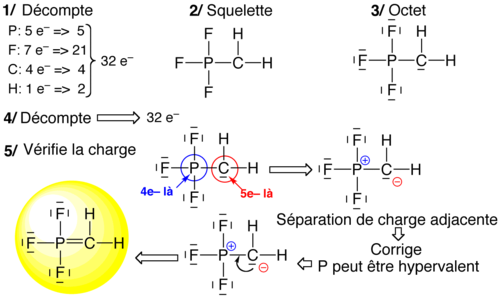
Quelques atomes sont connus pour violer la règle de l'octet. On parle d'hypervalence (soufre, phosphore, xénon) lorsqu'il y a plus de 8 électrons autour de l'atome, et de d'hypovalence lorsqu'il y a moins de 8 électrons (cas du bore notamment). Les atomes d'hydrogène ont 2 électrons autour d'eux dans la molécule[note 1]. On parle pour eux de règle du duet.
Lorsqu'un atome a exactement 6 électrons autour de lui, on parle d'une lacune (représentée par un petit rectangle vide). Le bore et les carbocations ont une lacune. La lacune confère à l'atome une acidité particulière pour les électrons voisins (acidité de Lewis).
Validité
Une structure de Lewis est une représentation simplifiée de la structure électronique. Les notions d'hypervalence ou d'hypovalence par exemple sont des caricatures de la densité électronique autour d'un atome. Au XXIe siècle, ils font encore l'objet de recherche[1].
La représentation de Lewis présente des cas problématiques :
- Dans le cas du dioxygène, la représentation de Lewis donne :
. Dans cette représentation, chaque électron se trouve en apparié (sous forme de doublet), ce qui donnerait à la molécule de dioxygène des propriétés diamagnétiques. Or celle-ci est paramégnétique, c'est-à-dire qu'elle présente des électrons non-appariés.
- Dans le cas du borane (BH3), le bore partage ses trois électrons avec les trois atomes d'hydrogène qui l'entourent, en formant trois liaisons simples. Il est alors entouré uniquement de six électrons, ce qui contredit la règle de l'octet. C'est aussi la cas de tous les composés trivalents du bore
Malgré ses limites, le modèle de Lewis est un outil indispensable pour les chimistes et permet d'expliquer la composition et la réactivité de nombreux composés, surtout en chimie organique. Par contre, il ne peut pas expliquer la réactivité des éléments de transition.
Différentes approches
Toutes les approches doivent se baser sur un squelette σ bien défini. Il existe différentes stratégies pour obtenir une structure de Lewis valide.
Règle du maximum de liaison
Sur le squelette moléculaire, on distribue les électrons restant de façon à faire un maximum de liaison ... tout en respectant l'octet. Elle consiste à partir des représentations de Lewis des atomes, et à associer les électrons célibataires des atomes en ayant plusieurs pour obtenir le squelette, puis à compléter par les atomes monovalents (H et halogènes) et liaisons multiples. Dans certains cas, deux électrons célibataires peuvent former un doublet non liant (cas des carbènes) ou deux électrons d'un doublet non liant peuvent former une liaison, appelée "covalente dative", ce qui permet de respecter la règle de l'octet, même dans les cas des acides nitrique, phophorique, sulfurique... et de contourner (dans certains cas spécifiques) l'idée d'hypervalence.
Règle de l'octet à outrance
La règle de l'octet à outrance[2] est l'approche la plus systématique.
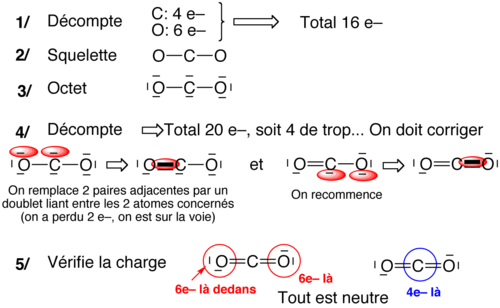
Sur le squelette moléculaire, on complète à l'octet tous les atomes (sauf hypovalents notoires) et on réajuste la quantité d'électron de façon à retrouver le nombre d'électron initial. Cet approche se fait en cinq étapes :
- Supposer un squelette (liaison simples)
- Compter le nombre total d'électrons de valence (n)
- Compléter à l'octet partout
- Compter le nombre d'électrons présents dans le schéma trouvé en 3 et comparer à n
- s'il manque des électrons, rajouter une paire libre sur l'atome pouvant être hypervalents
- s'il y a trop d'électrons, ôter 2 paires libres adjacentes et les remplacer par une liaison entre les atomes concernés (liaison multiples)
- Compter les charges, et réduire l'excès de charge +/- adjacentes en prenant un doublet libre du – et en faisant une liaison multiple vers son voisin + (si ce voisin peut être hypervalent).
Exemples d'application
Exemples
- Octet respecté
Molécule d'eau
- Octet non respecté par excès
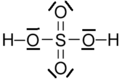
Molécule d'acide sulfurique
- Lacune (exemple de BH_3)
- Isomérie
l'isomérie H-C#N H-(+)N#C(-) montre que des structures de Lewis peuvent parfois aider à déterminer la connectivité d'une molécule.
Références
- ↑ Voir par exemple (en) Ronald J. Gillespie et Bernard Silvi, The octet rule and hypervalence: two misunderstood concepts, Coordination Chemistry Reviews, Vol 233-234, 1er novembre 2002, Pages 53-62
- ↑ Zumdahl, Chimie générale, 2e édition, éd. de Boeck, 1998, p. 270
Notes
- ↑ Puisque leur couche électronique externe est la couche K, qui n'en contient au maximum que deux, par application de la règle d'exclusion de Pauli
Articles connexes
- Portail de la chimie
Catégorie : Représentation des molécules - Dans le cas du dioxygène, la représentation de Lewis donne :
Wikimedia Foundation. 2010.