- Representation de Cram
-
Représentation de Cram
La représentation de Cram d'une molécule organique permet sa représentation dans l'espace : elle fait apparaître les liaisons en perspective. elle est très utile pour décrire les composés chiraux qui possèdent des carbones asymétriques. On doit cette représentation au chimiste américain Donald J. Cram.
Sommaire
Explication
Cette méthode de représentation se base sur quelques règles simples :
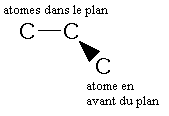
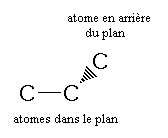
- Une liaison, entre 2 atomes dans le plan de la feuille, est représentée par un trait plein :
- Une liaison, entre un atome dans le plan et un atome en avant de la feuille, est représentée par un trait gras ou un triangle plein, la pointe étant du coté de l'atome dans le plan, la base du coté de l'autre atome:
- Une liaison, entre un atome dans le plan et un atome en arrière du plan, est représentée par un trait en pointillé ou un triangle hachuré dont la pointe est du coté de l'atome dans le plan, la base du coté de l'autre atome :
- On choisit comme plan de la feuille celui de la molécule qui contient le plus de liaisons, ainsi la molécule de méthane est représentée avec l'atome de C et deux atomes d'H dans le plan de la feuille, et non vue d'une direction transverse, qui donnerait deux triangles et deux traits en pointillé ; ainsi la molécule d'ammoniac doit être représentée avec deux liaisons N-H dans le plan et la dernière soit vers l'avant, soit vers l'arrière, et non avec l'atome d'azote seul dans le plan de la feuille, et comme on le voit parfois trois angles entre triangles de 120°, ce qui permet de plus d'indiquer l'angle précis entre deux liaisons.
Exemple
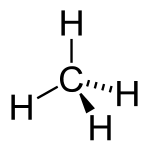 CH4 Méthane
CH4 MéthaneStructures
Dans le cadre de la théorie VSEPR, on désigne la géométrie de l'atome par AXnEm où n représente le nombre de substituants et m le nombre de doublets non liants. Pour un atome tétravalent (comme le carbone ou la silicium), 6 géométries sont alors possibles:
- AX4E0: 4 voisins, l'atome sera au centre d'un tétraèdre.
- AX3E1: 3 voisins et 1 doublet non liant, l'atome sera au sommet d'une pyramide.
- AX3E0: 3 voisins et aucun doublet non liant, l'atome sera au centre d'un triangle dont les angles font tous 120° et la représentation sera plane.
- AX2E2: 2 voisins et 2 doublets non liants, l'atome sera au milieu d'une coudée et la représentation sera plane.
- AX2E1: 2 voisins et 1 doublet non liant, l'atome sera au centre d'un triangle, et ses 2 voisins seront chacun situés à l'un des sommets et la représentation sera plane.
- AX2E0: 2 voisins, l'atome aura ses 2 voisins de chaque côté, ces derniers étant opposés et à 180° de l'autre et la représentation sera plane.
Pour tous les atomes, il est possible, à partir du nombre de doublets non liants et d'atomes liés, de connaître la géométrie autour de l'atome considéré (ci-après, on désigne un doublet non liant ou une liaison simple avec un atome par le terme général de doublet, et on ne tient pas compte des liaison pi) :
- 2 doublets : géométrie linéaire plane ; les deux doublets sont alignés.
- 3 doublets : géométrie triangulaire plane ; les doublets forment des angles de 120°.
- 4 doublets : géométrie tétraédrique ; les doublets forment des angles de 109,5°.
- 5 doublets : géométrie bipyramidale à base triangulaire. 3 atomes forment la base de la pyramide (angle de 120° entre eux) et 2 atomes forment les sommets des deux pyramides (angles de 90° avec les atomes de la base). En présence de doublets non liants, ceux-ci occupent la base de la pyramide (pour maximiser les angles des atomes avec le doublet non liant).
- 6 doublets : géométrie octaédrique (bipyramide à base carré) ; les doublets forment des angles de 90°.
- Portail de la chimie
Catégorie : Représentation des molécules
Wikimedia Foundation. 2010.