- KrF2
-
Difluorure de krypton
Difluorure de krypton 
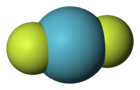
Structure du difluorure de krypton Général No CAS SMILES InChI Propriétés chimiques Formule brute KrF2 Masse molaire 121,795 g∙mol-1
F 31,2 %, Kr 68,8 %,Propriétés physiques Masse volumique 3 240 kg/m3 à 15 °C Unités du SI & CNTP, sauf indication contraire. Le difluorure de krypton, de formule KrF2, est le premier composé du krypton à avoir été identifié[1]. C'est un solide volatile incolore dont la molécule a une structure linéaire F-Kr-F avec des liaisons de 188,9 pm. Il forme des sels des cations KrF+ et Kr2F3+ avec les acides de Lewis forts[2].
Le difluorure de krypton est un puissant agent fluorant, capable de convertir le xénon et l'iode respectivement en hexafluorure de xénon et pentafluorure d'iode :
- Xe + 3 KrF2 → XeF6 + 3 Kr
- I2 + 5 KrF2 → 2 IF5 + 5 Kr
Le cation KrF+ est également le seul agent connu capable de conduire l'or à son état d'oxydation +5 :
- 8 KrF2 + 2 Au → 2 KrF+AuF6- + 6 Kr + F2
- KrF+AuF6- → AuF5 + Kr + F2 à plus de 60 °C
Notes et références
- ↑ A. V. Grosse, A. D. Kirschenbaum, A. G. Streng, L. V. Streng, "Krypton Tetrafluoride: Preparation and Some Properties", Science, 1963, volume 139, pages 1047-1048, DOI:10.1126/science.139.3559.1047
- ↑ J. F. Lehmann, D. A. Dixon, G. J. Schrobilgen, "X-ray Crystal Structures of α-KrF2, [KrF][MF6] (M = As, Sb, Bi), [Kr2F3][SbF6]•KrF2, [Kr2F3]2[SbF6]2•KrF2, and [Kr2F3][AsF6]•[KrF][AsF6]; Synthesis and Characterization of [Kr2F3][PF6]•nKrF2; and Theoretical Studies of KrF2, KrF+, Kr2F3+, and the [KrF][MF6] (M = P, As, Sb, Bi) Ion Pairs", Inorganic Chemistry 2001, volume 40, pages 3002-3017, DOI:10.1021/ic001167w
- Portail de la chimie
Catégories : Composé du fluor | Composé du krypton
Wikimedia Foundation. 2010.
