- Historique Du Concept De Molécule
-
Historique du concept de molécule
En chimie, l'histoire du concept de molécule retrace les origines du concept ou de l'idée de l'existence, dans la nature, d'une structure formée par la liaison de deux atomes ou plus, selon lesquels les structures de l'univers sont établies. En ce sens, le concept d'objets fondamentaux semblable aux concepts modernes de molécule et d'atome trouve ses origines au Ve siècle av. J.-C. du philosophe grec Leucippe qui soutenait le fait que tout l'univers se compose d'atomes et de vides. Cette idée sera développé plus tard, vers 450 av. J.-C. par le philosophe grec Empédocle, qui fonde la théorie des quatre éléments ; le feu, air, l'eau, la terre, ainsi que les forces qui leur sont associés ; l'attraction et la répulsion. Sur la base de ce raisonnement (alors purement philosophique) de nombreux scientifiques spéculeront tout au long de l'histoire sur la manière dont les éléments ou les atomes peuvent interagir entre eux en un système cohérent.
Sommaire
Étymologie
Le mot dérive du latin scientifique molecula, diminutif de moles (« masse ») et entre en français sous la plume de Pierre Le Gallois, en 1674, dans Conversations tirées de l'Académie de M. l'abbé Bourdelot, contenant diverses recherches et observations physiques avec le sens initial de « très petite partie d'un corps »[1].
Antiquité
Vers 485 av. J.-C., le philosophe grec Parménide se fonde sur un argument ontologique contre le néant, niant la possible existence du vide. En 460 av. J.-C., philosophe grec Leucippe, en opposition à Parménide, qui nie le vide, propose une théorie atomique, qui explique la raison pour laquelle tout dans l'univers est composé d'atomes ou de vide. Une théorie qui, selon Aristote, a été conçue pour contredire exprès les arguments de Parménide. Dans les années qui suivront, spécifiquement vers 450 av. J.-C., le disciple de Leucippe, Democritus, continue à développer l'hypothèse atomique en utilisant le terme atomos ; ce qui signifie littéralement l’« insécable ».
En plus des théories atomiques et avant le développement du concept de "molécule" s'établissent diverses théories essentielles d'élément. Dès le VIe siècle av. J.-C., le scientifique grec Thalès de Milet pensait que l'élément essentiel était l'eau et que toutes les choses dérivaient de cet élément. Selon la légende, Thalès marchait le long d'un chemin de flanc de coteau sur le rivage de Ionia, dans ce qui est aujourd’hui le sud-ouest de la Turquie, et il remarqua des roches contenant des fossiles de ce qui étaient unmistakably des seashells. Ceci a mené Thales à croire que ces collines avaient du autrefois faire partie de la mer. Sur cette logique, Thalès établi que le monde original devait avoir été entièrement composé d'eau, et que c'était donc l'élément essentiel.
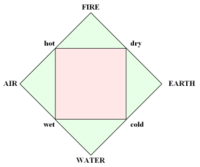
Au Ve siècle av. J.-C., le Grec Empédocle, étant influencé par Pythagore, proclame que toutes les choses sont composées des combinaisons différentes de quatre éléments :
Le terme "élément' (stoicheia) a été introduit pour la première fois par le philosophe grec Platon vers 360 av. J.-C. dans son dialogue Timée, qui comporte une discussion sur la composition des corps organiques et inorganiques et qui peut être considéré comme un traité rudimentaire de la chimie. Platon suppose que la particule fondamentale de chaque élément possède une forme géométrique précise : tétraédrique (feu), octaédrique (air), icosaédrique (eau), et cubique (terre).
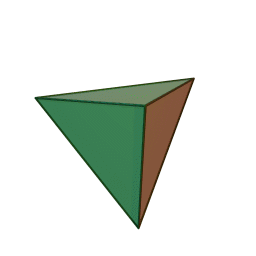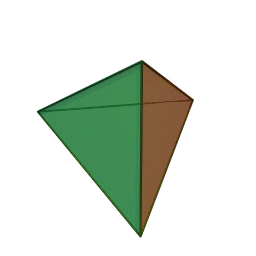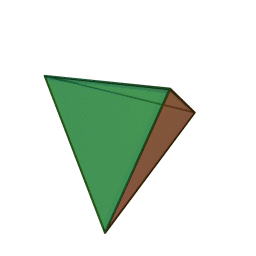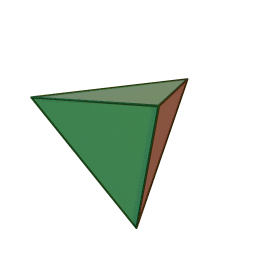
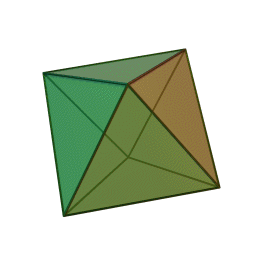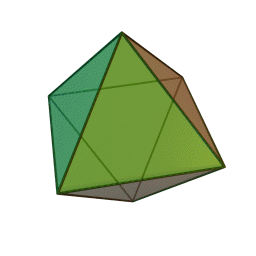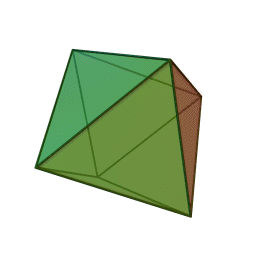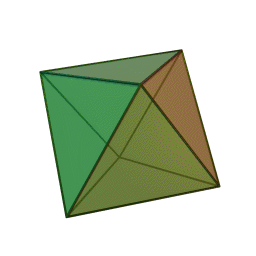
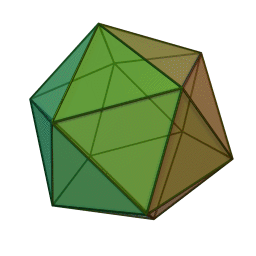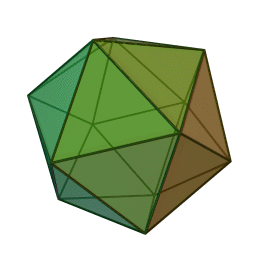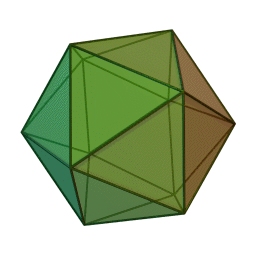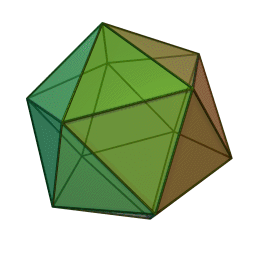
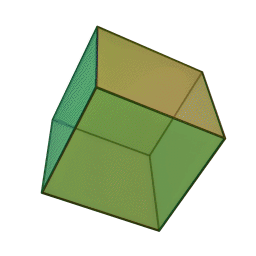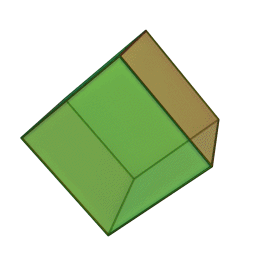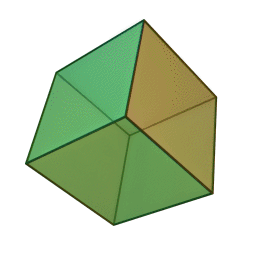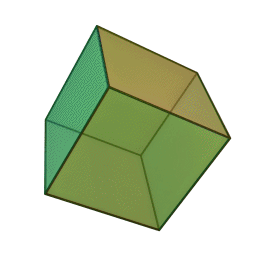
Tétraèdre (feu) Octaèdre (air) Icosaèdre (eau) Cube (terre) À cette théorie des quatre éléments, Aristote ajoute vers 350 av. J.-C., un cinquième élément ou "quintessence" ; ce qui forme les cieux. Sur base de cette logique, divers auteurs ont spéculé au cours du temps sur des formes géométriques possibles, telles que des cercles, carrés, et des polygones, etc., des éléments et comment ces formes pourraient se combiner, se repousser, ou interagir les unes contre les autres pour créer de nouveaux éléments.
Période médiévale
Au cours du Moyen Âge, c'est-à-dire de 500 à 1500, on observe un déclin général ou un frein dans le développement scientifique en Occident ; ce qui est à mettre en parallèle avec certaines objections de l'Eglise chrétienne et un déclin global de la civilisation dans son ensemble.[2]
Cependant, la période allant du dix au douzième siècle montre une période d'activité avec les écrits de Maïmonide, Thierry de Chartres, et William of Conches. Ces philosophes, bien qu'acceptant l'enseignement de base des écritures théologiques, font revivre les anciennes théories atomiques de manière à fournir une interprétation scientifiques de la Création et de la structure du monde.[2]
Maïmonide, par exemple, s'est principalement fondé sur la science d'Aristote et a essayé de réconcilier les philosophies du Talmud avec l'alchimie. Thierry de Chartres, suivant la logique des théories des quatre éléments, explique les raisons pour lesquelles la terre et l'eau, étant plus lourds, ont pris une position centrale en structures, tandis que l'air et le feu, étant plus légers, ont pris une position externe. De même, William des Conques, étant un partisan de la théorie des quatre éléments, clame que les éléments ont été divinement créés, pendant la genèse du monde, mais qu'ils sont maintenant soumis aux lois de la Nature. Il considère les atomes comme des particules « simples et extrêmement petites par lesquelles, selon leur juxtaposition, toutes les choses du monde physique ont été formées et dont les qualités ont été produites ». Après 1450, avec l'invention de l'imprimerie par Gutenberg, la pensée scientifique va commencer à s'accélérer.
XVIIe siècle
La plus ancienne théorie sur la forme et la connectivité entre les atomes date a été proposée par Leucippe, Démocrite et Épicure qui associaient la solidité d'un matériau à la forme que prenaient les atomes qui le compose. Selon cette théorie, les atomes de fer sont solides et durs et composés de crochets qui les relient entre eux pour former le métal. Les atomes d'eau, par contre, sont lisses et glissants ; les atomes de sels en raison de leur goût, sont pointus et aigus ; et les atomes d'air sont légers et tourbillonnant, infiltrant tous les autres matériaux. [3]. Le principal partisan de cette théorie étant Démocrite. En utilisant des analogies à partir de nos perceptions, il fourni une image de l'atome où ceux-ci sont distingués les uns des autres par leur forme, leur taille, et leur arrangements relatifs. De plus, la liaison était expliquée via des liens matériels où les atomes possédait des points d'attache : certains ayant des crochets et d'autres des creux. [4]
Curieusement, la théorie atomique fut abandonnée pendant près de deux millénaires au profit de la théorie des quatre éléments et plus tard des théories alchimiques. Toutefois, le XVIIe siècle voit ressurgir la théorie atomique à travers les travaux de Descartes, Gassendi et Newton, qui utilisent les anciennes théories atomiques grecques pour expliquer comment les particules ultimes de la matière se lient entre elles. Descartes imagine que les atomes sont attachés entre eux par des crochets microscopiques.[5] Par la suite, l'une des théories moléculaires les plus ancienne sera proposée par le célèbre naturaliste français René Descartes qui croyait que les atomes sont pourvus de crochets, et d'autres, avec des creux. Il soutenait que deux atomes se combinent quand le crochet de l'un se fait piéger dans le creux de l'autre, tel que montré ci-dessous :
Fichier:Hook-and-eye-model.jpgMock-up of René Descartes' "Hook-and-Eye" bonding Model (c.1625).[6]Vers le milieu des années 1770, les théories impliquant des particules comportants des crochets physiques était considérée comme de la "chimie cartésienne".[7] De manière similaire à Descartes, Gassendi, qui avait alors écrit un livre sur la vie d'Epicure, pense que la taille et la forme des atomes qui se déplacent dans le vide doit rendre compte des propriétés de la matière. La chaleur est due à des atomes petits et ronds ; le froid comme des atomes pyramidaux avec des coins pointus qui prend en compte la sensation de picotement lors de grand froid, tandis que les solide tiennent ensemble par des crochets entrelacés.[8]
Newton, connaissant les diverses théories d'attachement d'atome alors à la mode, c.est-à-dire. « atomes crochus », les « atomes collés » (des corps au repos), et '"liaisons par mise en commun" la théorie, croit plutôt, comme indiqué dans le célèbre "Principe 31" ; de son Opticks de 1704 ;, que les particules s'attirent les unes les autres par une certaine force, qui "en contact immédiat est extrêmement forte, à de petites distances effectue les opérations chimiques, et à longue distance ne crée pas d'effet sensible sur les particules." (a) [9]
Cependant, et de façon plus concrète, le concept des agrégats ou des unités d'atomes collés, c.-à-d. « molécules » ;, trouve ses origines dans l'hypothèse de Robert Boyle en 1661, dans son célèbre traité The Chymist sceptiques ;la matière se compose de clusters de particles ; et les changement chimique résulte du réarrangement du clusrer. Boyle affirme que les éléments de base de la matière sont composés de particules de diverses sortes et tailles, appelées "corpuscules" ;, qui sont capables de s'arranger en groupes. En 1680, en employant la théorie corpusculaire comme base, le chimiste français Nicolas Lémery stipule que l'acidité de n'importe quelle substance trouve ses origines dans ses particules aiguës, tandis que les alcalis sont dotés de pores de divers tailles.[10] Une molécule, selon ce point de vue, est composée de corpuscule unis par une fermeture géométrique entre des points et des pores.
XVIIIe siècle
La théorie de la combinaison par affinité chimique est le précurseur de l'idée d'une combinaison d'atomes liés entre eux. Par exemple, en 1718, le Français Étienne François Geoffroy, en se fondant sur le concept de combinaison de clusters développé par Boyle, développe la théorie des affinités chimiques pour expliquer les combinaisons de particules en estimant qu'une force alchimique assemble certains éléments entre eux. Le nom de Geofroy est mieux connu pour sa table des affinités chimiques (tables des rapports), présentée à l'Académie française en 1718 et 1720.
 Étienne François Geoffroy’s 1718 Affinity Table: at the head of the column is a substance with which all the substances below can combine.
Étienne François Geoffroy’s 1718 Affinity Table: at the head of the column is a substance with which all the substances below can combine.
Cette table reprenait les résultats obtenus par l'observation de l'action de différentes substances vis-à-vis d'une autre et montrait que des corps analogues présentaient une affinité différente pour différentes réactifs. Ces tables d'affinités resteront à la mode pour le reste du siècle jusqu'à son remplacement par les conceptions de Claude Louis Berthollet.
En 1738, un physicien et mathématicien suisse Daniel Bernoulli publie Hydrofynamica, qui restera le fondement de la théorie cinétique des gaz. Dans ce travail, Bernoulli propose l'argument, encore utilisé de nos jours, qu'un gaz consiste en un grand nombre de molécules se déplaçant dans toutes les directions, que la pression du gaz que l'on peut mesurer est causée par l'impact des molécules sur les surfaces qu'elles rencontrent et que ce que l'on perçoit comme de la chaleur est simplement l'énergie cinétique de leur mouvement. Cette théorie ne fut pas immédiatement acceptée, en partie du au fait que le principe de la conservation de l'énergie n'avait pas encore été établi et qu'il il n'était pas évident pour les physiciens de savoir comment les collisions entre les molécules pourraient être parfaitement élastiques.
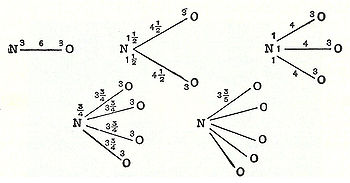
En 1789, William Higgin publie un travail sur ce qu'il appelle les combinaisons de particule "ultime", qui annonce le concept de la liaison de valence. Si, par exemple, selon Higgins, la force entre la particule ultime de l'oxygène et la particule ultime de l'azote est de 6, alors la force de la force est divisée en conséquence, et de manière similaire pour les autres combinaisons des particules ultimes :
XIXe siècle
D'une manière similaire, John Dalton, en 1803, prend le poids atomique de d'hydrogène, l'élément le plus léger, comme unité et détermine, par exemple, que le rapport pour l'anhydride d'azote était de 2 pour 3 ce qui donne la formule N2O3. Dalton imagine, à tort, que les atomes "s'accrochent" ensemble pour former des molécules. Plus tard, en 1808, Dalton publie son célèbre diagramme des "atomes" combinés :
Fichier:Daltons-particles.jpgJohn Dalton's union of atoms combined in ratios (1808)Amedeo Avogadro déclare dans son célèbre article de 1811 "Essay on Determining the Relative Masses of the Elementary Molecules of Bodies", que: [11]
« La plus petite particule constitutive d'un gaz n'est pas nécessairement un atome unique, mais une combinaison d'un certain nombre de ces atomes unis par des forces attractives pour former une molécule unique. »Il convient de signaler ici que cette citation est une traduction littérale. Avodagro utilise le terme "molécule" de manière similaire pour les atomes et les molécules. De manière spécifique, il utilise le terme "molécule élémentaire" lorsqu'il fait référence aux atomes et de "molécules composites" pour décrire la matière.
XXe siècle
Au début des années 1900, le chimiste américain Gilbert N. Lewis commença à dessiner des points lors de ses cours de chimie undergraduate à Harvard, afin de représenter les électrons présents autour des atomes. Ses étudiants appréciaient ces dessins et ceci l'encouragea à continuer dans cette direction. A partir de ses cours, Lewis s'aperçut que les éléments possédant un certain nombre d'électrons semblaient posséder une stabilité plus importante. Ce phénomène fut repéré par le chimiste allemand Richard Abegg en 1904, et Lewis s'y référait en lui donnant le nom de loi d'Abegg pour la valence et contre-valence. Lewis se rendit compte qu'une fois qu'un groupe de 8 électrons s'est formé autour d'un noyau, alors la couche est complète et une nouvelle couche commence à être remplie. Lewis s'aperçut aussi que les ions dont la couche extérieure est remplie de 8 électrons possède une stabilité particulière. A partir de ces observations, il proposa la règle de l'octet : les ions ou atomes comportant une couche remplie de 8 électrons ont une plus grande stabilité.
Par la suite, Lewis envisage l'atome comme ayant 8 sites disponibles pour les électrons, à la manière des coins d'un cube. Ainsi, il conçoit en 1902 une théorie selon laquelle ces atomes cubiques peuvent s'associer en formant des liaisons sur leurs cotés et ainsi créer des molécules de structures cubiques.
Autrement dit, des liaisons covalentes simples peuvent être formées lorsque 2 atomes partagent une arrête et mettent en commun deux électrons, comme dans la structure C ci dessous. De la même façon, des liaisons ioniques sont formées par le transfert d'un électron d'un cube à l'autre, sans qu'ils ne partagent une arrête (structure A). Lewis postule l'existence d'un état intermédiaire où seulement un coin est partagé (structure B).
Les doubles liaisons, qui résultent du partage de 4 électrons, sont donc formées par le partage d'une face entre deux atomes cubiques.
En 1913, alors qu'il travaille comme directeur du département de chimie de l'Université de Californie à Berkeley, Lewis lit une première version d'un article écrit par un étudiant en thèse anglais, Alfred Lauck Parson. Ce dernier suggérait que l'électron n'est pas seulement une charge électrique mais aussi un petit aimant (ou magnéton comme il le désigne) et qu'en outre, une liaison chimique est le résultat du partage des deux électrons entre deux atomes. Ceci, selon Lewis, signifiait que la liaison se formait quand deux électrons étaient partagés sur une arrête entre deux cubes différents.
Afin de pouvoir représenter les atomes et les molécules, Lewis introduit la "structure de Lewis" dans son article de 1916 L'atome et la molécule. Il se sert de points pour représenter les électrons et de lignes pour les liaisons covalentes. Dans cette publication, il développe le concept de liaisons covalentes, dans lesquelles deux atomes peuvent partager de un à six électrons, formant de cette manière soit une liaison une liaison simple, une liaison double ou une liaison triple.
XXIe siècle
Voir aussi
Références
- ↑ Trésor de la langue française informatisé.
- ↑ a et b Pullman, Reisinger, Axel et Bernard, The Atom in the History of Human Thought, Oxford University Press, . ,
- ↑ Jeremy, I., Nir, Shlomo, Pfeffer, Modern Physics: An Introduction Text, World Scientific Publishing Company, . ,
- ↑ See testimonia DK 68 A 80, DK 68 A 37 and DK 68 A 43. See also Ernst et Cassirer, An Essay on Man: an Introduction to the Philosophy of Human Culture, , 1953. ,
- ↑ John et Waller, Leaps in the Dark: the Making of Scientific Reputations, Oxford University Press, 2004. ,
- ↑ Disclaimer: this picture is just for illustration, at the time of Gassendi and Descartes, the composition of water was not known.
- ↑ Comments made by French chemist Guyton de Morveau in about 1772; as found in Kim’s 2003 Affinity That Elusive Dream – A Genealogy of the Chemical Revolution.
- ↑ Henry, M. et Leicester, The Historical Background of Chemistry, John Wiley & Sons, 1956. ,
- ↑ Isaac Newton, (1704). [ [ Opticks ] ]. (page 389). New York : Dover.(b) Modèle:Citez le livre
- ↑ Lemery, Nicolas. (1680). An Appendix to a Course of Chymistry. London, pgs 14-15.
- ↑ Avogadro, Amedeo (1811). "Masses of the Elementary Molecules of Bodies", Journal de Physique, 73, 58-76
Pour approfondir
Liens externes
- Portail de la chimie
Catégorie : Histoire de la chimie
Wikimedia Foundation. 2010.