- Hexaméthylphosphoramide
-
Hexaméthylphosphoramide 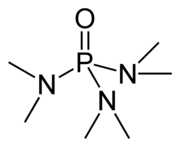
Général Synonymes Hexametapol
HMPA(angl)
HMPTNo CAS No EINECS SMILES InChI Apparence liquide incolore, mobile, d'odeur caractéristique[1]. Propriétés chimiques Formule brute C6H18N3OP [Isomères] Masse molaire[3] 179,2004 ± 0,007 g·mol-1
C 40,21 %, H 10,12 %, N 23,45 %, O 8,93 %, P 17,28 %,Diamètre moléculaire 0,702 nm [2] Propriétés physiques T° fusion 7,2 °C [4] T° ébullition 232,5 °C [4] Solubilité 1 000 g·l-1 (eau) [4] Masse volumique 1,03 g·cm-3[1] Point d’éclair 105 °C[1] Pression de vapeur saturante 0,046 mmHg 25 °C [4] Précautions Directive 67/548/EEC 
TPhrases R : 45, 46, Phrases S : 45, 53, SIMDUT[6] 
SGH[7] 
DangerClassification du CIRC Groupe 2B : Peut-être cancérogène pour l'homme[5] Écotoxicologie DL50 2 400 mg·kg-1 (souris, oral)
800 mg·kg-1 (souris, i.v.)
1 600 mg·kg-1 (souris, i.p.) [4]Unités du SI & CNTP, sauf indication contraire. L'hexamethylphosphoramide, abrégé HMPA (Différent de HMPT= hexamethyl phosphorotriamide), est un liquide organique incolore de formule brute C6H18N3PO.
Sommaire
Généralités
Il est utilisé comme solvant polymérique, comme solvant selectif pour les gaz, inhibiteur de la dégradation thermique du polystyrène, comme solvant pour les organometalliques et autres réactions organiques en laboratoire. Des tests ont prouvé son efficacité en tant que substance anti-feu, ainsi que stérilisant chimique chez l'insecte, mais il n'y a pas actuellement d'utilisation connue de ce produit pour ces deux applications. Il est très utile pour améliorer la sélectivité de certaines réactions. Par exemple, lors des réactions de protonation, l'HMPT permet de rompre les oligomeres de lithium basiques à l'instar du butyl lithium. En raison de sa capacité à solvater les cations sans solvater les anions, le HMPA est utilisé comme solvant pour réaliser des réactions de SN2 particulièrement délicates. L'oxygène basique solvate bien le cation Li+[8]. HMPA est l'oxyde de la phosphine tertiaire la plus basique P(NMe2)3. Comme la plupart des oxydes de phosphine (ex. l'oxyde de triphénylphospine), la molécule présente un noyau tétraédrique et la liaison P-O et très polarisée ; ainsi la charge négative présente sur l'oxygène est significative.
Réactifs alternatifs
Le diméthylsulfoxyde (DMSO) peut souvent être employé comme solvant en remplacement du HMPA. Ces deux composés présentent un fort site accepteur de liaison hydrogène et leurs oxygènes sont capables de former une liaison avec un cation métallique.
Toxicité
Le HMPA est peu toxique mais a tout de même été tenu responsable de cancers nasaux chez le rat[8] . De plus, il peut être dégradé en composés moins toxiques, par action de l'acide chlorhydrique.
Notes et références
- TRIAMIDE HEXAMETHYLPHOSPHORIQUE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, 1999, 239 p. (ISBN 0-471-98369-1)
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) « Hexamethylphosphoramide » sur ChemIDplus, consulté le 6 février 2009
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2B : Peut-être cancérogènes pour l'homme » sur http://monographs.iarc.fr, CIRC, 16 janvier 2009. Consulté le 22 août 2009
- « Hexaméthylphosphorotriamide » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Dykstra, R. R. "Hexamethylphosphoric Triamide" Encyclopedia of Reagents for Organic Synthesis, 2001 John Wiley & Sons, Ltd. DOI: 10.1002/047084289X.rh020
- Merck Index, 12th Edition, 4761.
Liens externes
Catégories :- Composé du phosphore
- Produit chimique toxique
- Cancérogène chimique
- Produit chimique mutagène
- Solvant
- Cancérogène du groupe 2B du CIRC
Wikimedia Foundation. 2010.
