- Glowstick
-
Un glowstick ou lightstick, souvent appelé snaplight (marque déposée) ou cyalume (marque déposée pour le diphenyl oxalate, mais dénomination courante en français), est un tube de plastique, fermé de manière étanche à ses extrémités, contenant deux composés chimiques distincts séparés par une capsule de verre de faible résistance. La rupture de cette capsule, qui se fait par flexion du tube de plastique, a pour effet de mélanger les deux produits et de produire de la lumière par réaction chimique, sans apport énergétique externe (chimiluminescence produisant une lumière par fluorescence).
Sommaire
Caractéristiques
Une fois le tube « activé », le mélange continu des réactifs produit une lumière de faible intensité, qu'il n'est pas possible de stopper facilement avant consommation complète des réactifs. Cependant, la réaction est notablement ralentie par les basses températures, et au contraire fortement accélérée par la chaleur. La durée d'éclairement est variable suivant les modèles (de cinq minutes à douze heures à température ambiante); celle-ci est, dans une certaine mesure, inversement proportionnelle à l'intensité de la lumière produite. Les modèles ayant une durée de vie de douze heures produisent une lumière comparable à la clarté produite par la flamme d'une bougie.
Le mélange chimique met en œuvre les propriétés du luminol (3-aminophthalhydrazide), qui produit une lueur par un phénomène de chimiluminescence une fois en présence d'ions d'hydroxydes et d'oxygène (réaction d'oxydo-réduction). Les avantages de ce type d'éclairage tiennent surtout du fait qu'ils ne sont ni toxiques, ni inflammables, ni comburants, ni déflagrants (aucune pression interne). Ils ne produisent aucune étincelle ou flamme, ni à l'allumage, ni en fonctionnement. Ils flottent sur la plupart des liquides grâce à la présence d'une petite quantité d'air enfermée à l'intérieur du dispositif.
Ces propriétés en font des éclairages de secours idéaux dans des atmosphères confinées (silos, etc.) ou explosives (fuite de gaz inflammables, par exemple). Ils sont relativement bon marché et la fiabilité de fonctionnement élevée de ces dispositifs ne peut guère être mise en échec que par le perçage du tube de plastique, qui est par ailleurs hautement résistant aux contraintes mécaniques. Il est ainsi possible d'appliquer sur le dispositif une masse de plusieurs dizaines de kilogrammes sans y occasionner de dégâts notables. Évidemment, ces tubes ne requièrent pas de batterie. Leur durée de stockage avant utilisation varie de deux à cinq ans. Ces dispositifs existent en diverses longueurs, diamètre et couleurs de lumière.
 Composition d'un cyalume : tube originel à gauche ; puis tube ouvert, solution de péroxyde versée dans une éprouvette graduée et ampoule de fluofore retirée ; puis ces trois items placés sous illumination UV, montrant leur fluorescence ; puis phénomène de chimiluminescence lors du mélange de ces composés ; puis à droite, le mélange replacé dans le tube plastique, montrant la légère variation de teinte.
Composition d'un cyalume : tube originel à gauche ; puis tube ouvert, solution de péroxyde versée dans une éprouvette graduée et ampoule de fluofore retirée ; puis ces trois items placés sous illumination UV, montrant leur fluorescence ; puis phénomène de chimiluminescence lors du mélange de ces composés ; puis à droite, le mélange replacé dans le tube plastique, montrant la légère variation de teinte.
Chimie
Le glowstick contient des composés chimiques variables ainsi qu'un colorant fluorescent (typiquement un fluorophore). La solution contenue dans le tube est un mélange du colorant et d'un luminol (ester), par exemple un dérivé de diphenyl oxalate (le « cyalume » à proprement parler). La capsule interne contient elle un peroxyde d'hydrogène (eau oxygénée). Le mélange des deux induit une réaction chimique lors de laquelle l'ester est oxydé et donne deux molécules de phénol et une molécule de 1,2-dioxétanedione. Cette dernière se décompose spontanément en dioxyde de carbone, ce qui produit de l'énergie qui excite le colorant. Celui-ci se désexcite en émettant un photon. La longueur d'onde du photon, ie. la couleur de la lumière émise, dépend de la structure du colorant.
Les colorants utilisés dans les glowsticks produisent généralement de la fluorescence lorsque soumis à un rayonnement ultraviolet, si bien qu'un tube déjà utilisé rayonnera encore sous une lumière noire. En ajustant les concentrations relatives des réactifs, les industriels peuvent produire des glowsticks qui rayonnent vivement pendant un temps bref ou faiblement sur une longue durée.
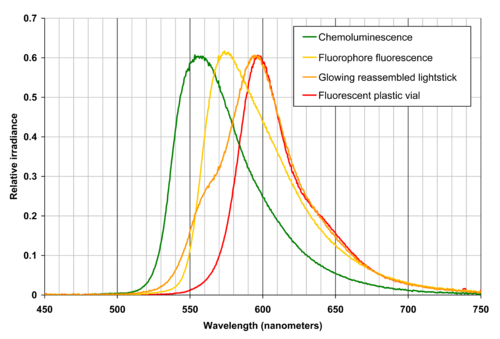 En vert : spectre d'émission par chimiluminescence pour un mélange de fluorophore et peroxyde retiré du tube ; en orange : fluorescence du fluorophore seul avant mélange, dans sa capsule, sous lumière noire ; en rouge : fluorescence du tube de plastique externe sous lumière noire ; en orange foncé : spectre total du glowstick dans le tube orangé. Ce graphique montre que la lumière orangée issue d'un glowstick orange est créée par une lumière vert-jaune issue d'un liquide émetteur de fluorescence.
En vert : spectre d'émission par chimiluminescence pour un mélange de fluorophore et peroxyde retiré du tube ; en orange : fluorescence du fluorophore seul avant mélange, dans sa capsule, sous lumière noire ; en rouge : fluorescence du tube de plastique externe sous lumière noire ; en orange foncé : spectre total du glowstick dans le tube orangé. Ce graphique montre que la lumière orangée issue d'un glowstick orange est créée par une lumière vert-jaune issue d'un liquide émetteur de fluorescence.
Fluorophores courants
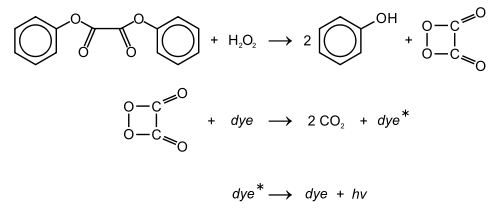
- 9,10-diphénylanthracène (DPA) : lumière bleue
- 1-chloro-9,10-diphénylanthracène (1-chloro(DPA)) and 2-chloro-9,10-diphénylanthracène (2-chloro(DPA)) : lumière bleue-verte plus efficacement que le DPA simple ; dihydro(DPA) violet
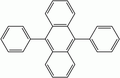
- 9,10-bis(phényléthynyl)anthracène (BPEA) : lumière verte
- 1-chloro-9,10-bis(phényléthynyl)anthracène : lumière vert-jaune, utilisée dans les cyalumes haute intensité de 30 min
- 2-chloro-9,10-bis(phényléthynyl)anthracène : lumière verte, utilisée dans les cyalumes basse intensité 12 h
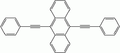
- 1,8-dichloro-9,10-bis(phényléthynyl)anthracène : lumière jaune des cyalumes usuels
- rubrène : lumière jaune
- 2,4-di-tert-butylphényl 1,4,5,8-tétracarboxynaphthalène diamide : lumière rouge intense, utilisé avec le DPA pour produire une lumière blanche ou rose fluo selon les proportions
- Rhodamine B : lumière rouge mais rarement utilisé car mauvaise réaction avec le phenyl oxalate
- 5,12-bis(phényléthynyl)naphtacène : lumière orangée
-
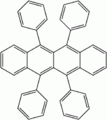
rubrène (5,6,11,12-tétraphénylnaphthacène) : lumière jaune
-
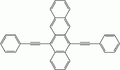
5,12-bis(phényléthynyl)naphtacène : lumière orange
-
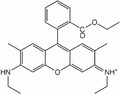
Rhodamine 6G : lumière orange
-
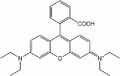
Rhodamine B : lumière rouge
Utilisations
Ce type de dispositif est utilisé surtout par les professionnels de la spéléologie, de la sécurité, de plongée sous-marine, ainsi que par les militaires. Certains sites industriels à risque (fabrication d'engins pyrotechniques, etc.) en font également usage. Ces dispositifs permettent notamment de baliser un obstacle, une issue, mettre en place une « ligne de vie » lumineuse, de repérer la position d'un coéquipier dans le noir, etc.
De plus petits dispositifs, cependant très similaires, sont utilisés par les barmans pour décorer les cocktails dans les bars, et sont maintenant utilisés lors des concerts par les spectateurs afin d'encourager leurs artistes préférés en agitant ces bâtons lumineux dans le noir.
Voir aussi
Les cyalumes reproduisent la lumière naturelle des insectes et du phytoplancton et zooplancton. ainsi on les utilise dans la pêche au thon et espadon car ils simulent la lumière des calmars par exemple. En général les cyalumes verts sont les plus attractifs pour la pêche.
Articles connexes
Liens externes
- (en) La chimiluminescence — Université de Michigan
- (en) How light sticks work
- (en) Vidéo : How to make a lightstick — Wired science
Wikimedia Foundation. 2010.