- 121-69-7
-
Diméthylaniline
- Cet article traite de la N,N-diméthylaniline. Pour les autres isomères, voir l'article « Xylidine ».
Diméthylaniline 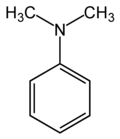
Structure de la diméthylanilineGénéral Nom IUPAC N,N-diméthylaniline Synonymes DMA No CAS No EINECS SMILES Apparence Liquide incolore Propriétés chimiques Formule brute C6H5N(CH3)2 Masse molaire 97,1582 g∙mol-1
C 74,17 %, H 11,41 %, N 14,42 %,Propriétés physiques T° fusion 2 °C T° ébullition 194 °C Masse volumique 956 kg/m3 Précautions Directive 67/548/EEC 
T
NPhrases R : 23/24/25, 40, 51/53, Phrases S : (1/2), 28, 36/37, 45, 61, Classification du CIRC Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[1] Unités du SI & CNTP, sauf indication contraire. La diméthylaniline est un composé chimique de formule C6H5N(CH3)2, plus précisément l'isomère ayant deux groupes méthyle sur l'azote de l'aniline, appelé pour cette raison N,N-diméthylaniline dans la nomenclature UICPA. Il s'agit donc d'une amine aromatique tertiaire, qui se présente normalement sous forme d'un liquide huileux incolore lorsqu'il est pur, mais dont les échantillons commerciaux sont généralement jaunâtres.
Préparation et réactions
La diméthylaniline est produite industriellement par alkylation de l'aniline en présence d'un catalyseur acide[2] :
La DMA donne la plupart des réactions de l'aniline. Elle est faiblement basique, et réagit avec les électrophiles. Sa nitration donne du tétryle (ou tétralyte), un dérivé à quatre groupes nitro utilisé autrefois comme explosif. Elle peut être lithiée avec le butyllithium. Sa méthylation donne un sel d'ammonium quaternaire[3] :
- C6H5N(CH3)2 + → [C6H5N+(CH3)3][CH3OSO3]–
Applications
La diméthylaniline est utilisée dans la réticulation de résines polyester et vinyl ester. Elle intervient également comme précuseur dans d'autres synthèses organiques.
Références
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ Thomas Kahl, Kai-Wilfrid Schröder, « Aniline » dans Ullmann's Encyclopedia of Industrial Chemistry 2007, John Wiley & Sons, New York.
- ↑ (en) J. Jacques et A. Marquet, Selective α-Bromination of an Aralkyl Ketone with Phenyltrimethylammonium Tribromide: 2-Bromoacetyl-6-methoxynaphthalene and 2,2-Dibromoacetyl-6-Methoxynaphthalene, 1988
- Portail de la chimie
Catégories : Produit chimique toxique | Produit chimique dangereux pour l'environnement | Aminobenzène
Wikimedia Foundation. 2010.
